澳大利亚医疗器械认证简介
多国法规 2022-07-081主管机构和核心法规澳大利亚的医疗器械,普通医疗器械和IVD产品需在澳大利亚药品注册库(ARTG)中列名后,所有在澳大利亚销售的医疗器械必须在澳大利亚医疗用品管理局(TherapeuticGoodsAdministration,简称TGA注册)TGA是发证机构也是医疗用品管理局,对此业内把医疗器械产品进行澳大利亚TGA注册的过程称为TGA认证。... 阅读全文
其他国家 澳大利亚 TGA
菲律宾医疗器械注册
多国法规 2022-07-06认证模式2019年4月1日实施的新规定要求风险A类医疗器械获得医疗器械通知证书(CMDN),风险B、C和D类医疗器械获得医疗器械注册证书(CMDR)才能获得在菲律宾进口并投放市场。研究临床试验展品捐赠和/或新颖审核流程注意事项1.只有获得经营许可证(LTO)的当地机构才能在菲律宾注册医疗器械。3.质量体系合格评定B、C和D类设备都需要ISO13485或FDA或日本PMDA的审核报告。... 阅读全文
其他国家 菲律宾注册
印度尼西亚医疗器械认证简介
多国法规 2022-07-06医疗器械和IVD必须获得卫生部颁发给当地特许经销商的注册号和产品许可证(AKA营销许可证)。在印度尼西亚注册医疗器械所需的文件注册申请必须按照东盟共同提交档案模板(CSDT)提交。... 阅读全文
其他国家 印尼注册
沙特医疗器械认证简介
多国法规 2022-07-06根据沙特阿拉伯医疗器械法规,SFDA接受将主型号、相关型号、附件作为组合到一个单独申请中。在沙特阿拉伯销售之前,设备必须在参考国家(澳大利亚、加拿大、欧洲、日本或美国)获得授权。... 阅读全文
其他国家 沙特注册
东盟十国ASEAN新法规推动更便捷、正规的注册路径(含缅甸、柬埔寨)
多国法规 2022-07-06东南亚国家联盟(ASEAN)签署了一项协议,即《东盟医疗器械指令》(AMDD),旨在协调医疗器械法规。AMDD为医疗器械制造商提供了一条更直接的市场途径。... 阅读全文
泰国注册 越南注册 马来西亚注册 新加坡注册 菲律宾注册 柬埔寨注册 印尼注册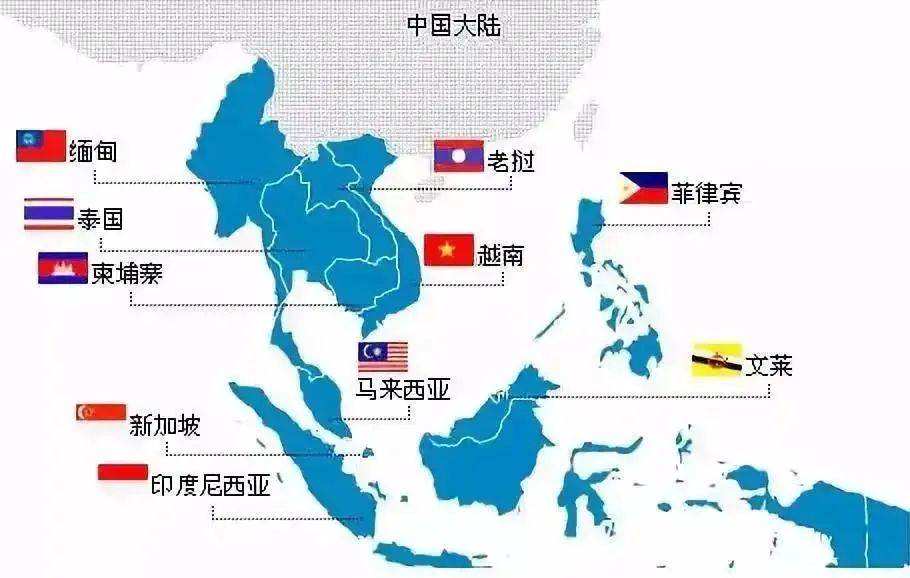
医疗器械多国注册方案介绍
多国法规 2022-07-06澳大利亚/加拿大/巴西/日本/墨西哥/马来西亚/瑞士... 阅读全文
巴西 ANVISA 日本注册 瑞士注册 澳大利亚 TGA 加拿大 HC 马来西亚注册 墨西哥注册
日本医疗器械注册详情
多国法规 2022-07-06日本根据医疗器械可能对人体造成风险的高低,将器械分为四类,即I类、II类、III类和IV类。日本的注册途径取决于各种因素,例如设备类别、分配的 JMDN码、对比设备的可用性以及相关日本工业标准 (JIS) 的可用性。... 阅读全文
其他国家 日本注册
医疗器械出口泰国不再接受FSC!
多国法规 2022-07-06二、认证模式低风险的普通I类设备必须在泰国进口和销售之前列名,I类无菌和测量设备需要提交测试报告才能将这些设备投放市场。(1)载明医疗器械名称和说明、标签、产品规格、医疗器械生产信息或者产品(2)所有人详细信息的文件,(5)用于测量的医疗器械生产或者进口时的测试或者校准证明文件;(7)产品所有人在提交医疗器械进口申请时作为代理人的授权书;... 阅读全文
其他国家 泰国注册
医疗器械出口认证-小众国家注册
多国法规 2022-07-06欧美市场虽然是医疗器械出口的大头,但是受制于市场容量、贸易摩擦及法规升级等各种因素,这两年越来越多的医疗器械生产厂商发现订单量下降了,亟需开辟新的市场。这就不得不提到了本文的重点:小众国家。各位厂商完全可以将自己的产品注册到这些市场,从而获得新的订单增量。许多厂商的实践证明,小众国家的订单量一点也不小。... 阅读全文
韩国 KFDA 英国 UKCA 巴西 ANVISA 日本注册 瑞士注册 澳大利亚 TGA 加拿大 HC 越南注册 马来西亚注册 墨西哥注册 哥伦比亚注册 新加坡注册 菲律宾注册 新西兰注册 土耳其注册 沙特注册 印度注册 迪拜注册 柬埔寨注册 印尼注册
东南亚各国新冠自测试剂盒注册要求
多国法规 2022-03-30泰国当地法人(2) :协调测试(3) :需要获得认可机构(来自美国、欧盟、加拿大、澳大利亚或日本)的批准2. 注册周期≥6个月3.注册流程;(1)韩国持证人;韩国当地法人 :注册周期≥6个月;见指南文件新加坡只有卫生部(MOH)确定有临床需求的自我测试才有资格获得HSA在大流行特殊访问途径(PSAR)下的评估:(1)菲律宾持证人;菲律宾当地法人 :... 阅读全文
产品注册许可 医疗器械
