东南亚各国新冠自测试剂盒注册要求
2022-03-30
随着国内疫情统计数据屡破新高,国内对新冠自测试剂盒的需求量是不言而喻的。然而高额的临床费用和严格的检测要求让很多厂商却步。如果是这样,您可以了解一下海外诸国对新冠自测试剂盒注册的要求,很多国家其实并不是那么“高不可攀”。
泰国
1. 必要条件:
(1) 泰国持证人:泰国当地法人
(2) 当地测试:性能测试(≥220个样品)
2. 注册周期:3-4个月
3. 注册流程:

马来西亚
1. 必要条件:
(1) 马来持证人:马来当地法人
(2) 当地测试:协调测试
(3) 需要获得认可机构(来自美国、欧盟、加拿大、澳大利亚或日本)的批准
2. 注册周期≥6个月
3. 注册流程:
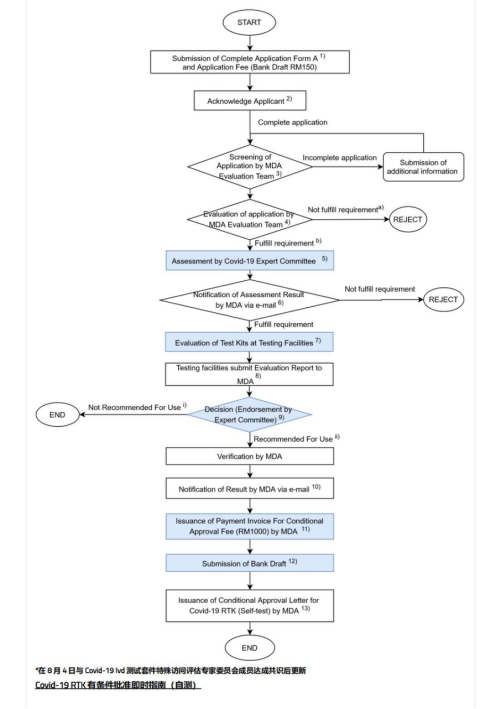
韩国
1. 必要条件:
(1) 韩国持证人:韩国当地法人
(2) 当地测试:需要,或有符合韩国MFDS准则的临床性能试验报告,则无需进行额外的临床性能试验KGMP:鉴于当前疫情期间的特殊情况,不方便审核体系,可以ISO 13485申请
2. 注册周期≥6个月,有CE认证,则可加速审批
3. 注册流程及测试要求:见指南文件

新加坡
只有卫生部 (MOH) 确定有临床需求的自我测试才有资格获得 HSA 在大流行特殊访问途径 (PSAR) 下的评估。在授予 PSAR 授权之前,HSA 将根据公司积累的数据评估自测,以确定它们是否符合安全、质量和有效性的适当标准。
1.分类:Class D
2.审核时间:
(1)全程330天,
(2)简化220天(至少1个认可的监管机构的批准:美国FDA,澳大利亚TGA,欧盟EU,日本MHLW,加拿大HC),
(3)快速180天(至少两个认可的监管机构的批准:美国FDA,澳大利亚TGA,欧盟EU,日本MHLW,加拿大HC)
3.所需材料:

菲律宾
1.必要条件:
(1)菲律宾持证人:菲律宾当地法人
(2)当地测试≥100个样品,需要,或有符合韩国MFDS准则的临床性能试验报告,则无需进行额外的临床性能试验KGMP:鉴于当前疫情期间的特殊情况,不方便审核体系,可以ISO 13485申请
2. 所需文件:需授权函,ISO13485,EC或同等证书(认可的第三方国家监管包括:美国FDA,澳大利亚TGA,欧盟EU,新加坡HSA,马来西亚PMDA,韩国MFDS,加拿大HC等)
3. 注册周期
(1) 审核: ≥6 个月
(2) 测试: 2 个月
越南
1. 越南证人:越南当地法人
2. 当地测试:全检(有CE/FDA认证除外)
3. 所需文件:
· 申请表
· 分类证书、授权书、符合性声明等。
· 自由销售证书 (CFS)
· 质量管理体系证书 (ISO 13485)
· 越南语注册持有人发布的 IFU 和技术摘要
· 越南标签
需授权函,ISO13485,EC或同等证书
4. 注册周期
(1) 一般审核: ≥90天
(2) 快速审核: 10天(认可的第三方国家监管包括:美国、欧洲、日本、澳大利亚和加拿大,并添加中国和韩国作为参考国家。)
