什么是 ISO 9001?
体系标准 2022-07-28但已实施ISO9001质量管理标准的公司数量仍然在全球范围内保持稳定。整个文档定义了一套指导企业如何创建产品或服务并将其交付给顾客的内部规则。质量管理体系必须结合您的企业和您所提供的产品或服务的需求量身打造,定义质量管理体系范围以及确定过程及其相互作用的要求。——领导作用要求涵盖了最高管理者在实施质量管理体系方面发挥作用的必要性。... 阅读全文
ISO 体系 ISO 9001
FDA提案修订21 CFR第820部分,对齐ISO 13485:2016
美国法规 2022-07-28这项新提案旨在调整和协调当前的医疗器械法规21CFR820和ISO13485:FDA一直有兴趣寻求与ISO13485要求的协调以对应全球QMS的要求,名为质量管理体系法规(QMSR)的提案新规则/法规包括了附加定义、概念澄清和附加要求等内容,FDA对所有提议的变更给出了透明的概述,建议销往美国的医疗器械制造商阅读此提案的新规则。... 阅读全文
CFR 820 美国法规
什么是QSR 820?
美国法规 2022-07-28是FDA法规中对于医疗器械质量管理体系的相关要求。医疗器械制造商以及拟将产品销往美国的外国(人用)医疗器械制造商必须遵守的质量管理体系法规QSR820。是多数医疗器械在美国上市之前必须遵守、上市之后随时可能抽查的基本要求。监管方式FDA不会像NMPA一样在发放许可证之前先进行体系考核。FDA对于所有的企业的体系考核是通过后续的抽查形式来进行监控的,全球的医疗器械注册企业都会有被抽查到的可能性。... 阅读全文
QSR 820 美国法规
菲律宾 CMDN & CMDR 认证
多国法规 2022-07-122019年4月1日实施的新规定要求风险A类医疗器械获得医疗器械通知证书(CMDN),风险B、C和D类医疗器械获得医疗器械注册证书(CMDR)才能获得在菲律宾进口并投放市场。·研究·临床试验·展品·捐赠和/或新颖三、其他事项1.只有获得经营许可证(LTO)的当地机构才能在菲律宾注册医疗器械。... 阅读全文
其他国家 菲律宾注册
马来西亚医疗器械认证不再需要FSC
多国法规 2022-07-08马来西亚的医疗器械产品注册由马来西亚卫生部(MoHM)下属的医疗器械管理局(MDA)监督。医疗器械在进口和投放市场之前需要在MDA注册。可能影响医疗器械分类的风险级别取决于预期用途、设计、制造和使用过程中应用的风险管理技术的有效性、预期用户、操作模式和使用的技术。3认证模式非马来西亚本地医疗器械制造商需要在其境内有当地企业作为其代表。... 阅读全文
其他国家 马来西亚注册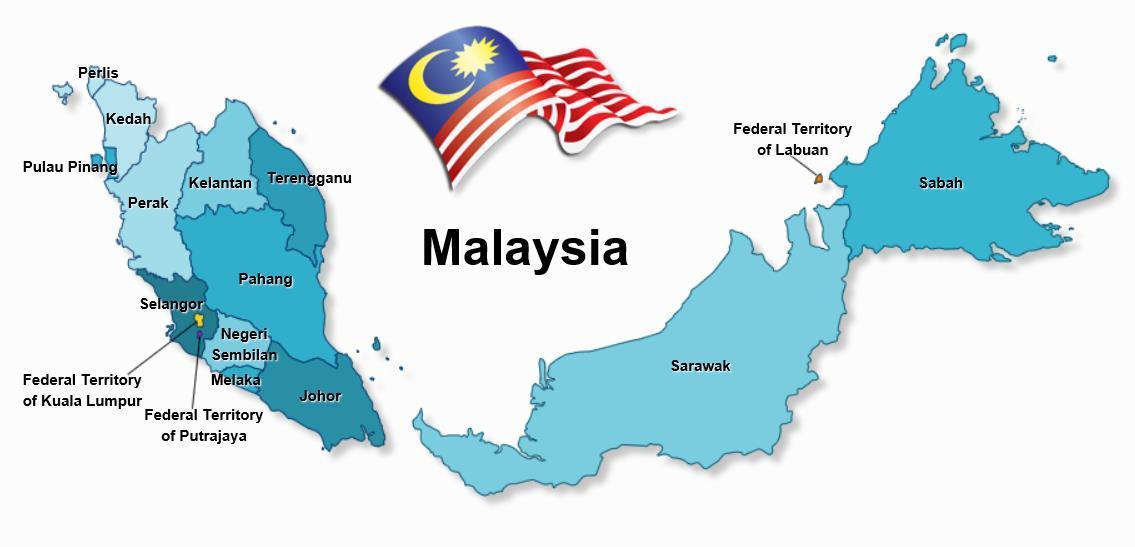
2022 年起,出口到越南的医疗器械需在越南注册
多国法规 2022-07-08一、主管机构和核心法规越南医疗器械产品注册由卫生部(MOH)下属的医疗设备和建设部(DMEC)监督。医疗器械在越南根据预期用途、风险等级、交付方式和对人体的侵入程度进行分类。三、认证模式A类和B类设备受卫生部省级办公室监督的通知程序的约束。没有参考国家批准或国家标准的C类和D类申请将需要进行可能需要长达90天的技术审查。具有参考国家批准或相同国家标准的产品将避免技术审查。... 阅读全文
其他国家 越南注册
新加坡医疗器械四种审核路径满足不同企业注册需求
多国法规 2022-07-08所有医疗器械在新加坡供应之前都需要向HSA注册,未获得参考国家/地区批准的设备需经过完整注册流程。已获得参考监管机构至少一项批准的医疗器械的评估途径(TGA–澳大利亚、HC–加拿大、MHLW–日本、FDA–美国、EC证书–欧盟公告机构)3.即时/快速评估途径(加急)——医疗器械的评估途径:... 阅读全文
其他国家 新加坡注册
医美产品出口韩国要求
多国法规 2022-07-08三、认证模式及审核流程3.1I类和II类设备由国家医疗设备安全信息研究所(NIDS)的“普通一类产品免于技术审查和KGMP认证。及其一类重复使用设备监管方式与II类设备相同。普通I类医疗器械制造商可以在将注册信息上传到MFDS电子门户后完成产品注册。预期用途、工作原理(MoA)、操作(功能)结构、原材料、使用说明、测试规范等信息。... 阅读全文
韩国法规 其他国家
澳大利亚医疗器械认证简介
多国法规 2022-07-081主管机构和核心法规澳大利亚的医疗器械,普通医疗器械和IVD产品需在澳大利亚药品注册库(ARTG)中列名后,所有在澳大利亚销售的医疗器械必须在澳大利亚医疗用品管理局(TherapeuticGoodsAdministration,简称TGA注册)TGA是发证机构也是医疗用品管理局,对此业内把医疗器械产品进行澳大利亚TGA注册的过程称为TGA认证。... 阅读全文
其他国家 澳大利亚 TGA

