MDCG 2022-16最新指南
欧盟法规 2022-11-03该指南文件是为授权代表、制造商和其他经济经营商编写的,指定和授权如果设备制造商未在成员国成立,如果器械属于不同的通用器械组(如MDR 登记验证和义务授权代表应遵守MDR 这意味着授权代表必须在EUDAMED中登记其详细信息;①自身的注册信息发生任何变化后一周内更新②根据MDRArticle31(5)/IVDRArticle28(5)规定的时间间隔提交数据。... 阅读全文
标准解读 欧盟 CE 认证
什么是协调标准
欧盟法规 2022-10-24制造商、其他经济运营商或合格评定机构可使用协调标准来证明产品、服务或工艺符合相关的欧盟法规。标准是包含技术信息以一致方式指导或定义实践的已发布文件,医疗器械法规下的协调欧洲标准由欧洲标准化组织根据EC按法规(EU)1025/2012发布的标准化请求制定。协调标准是由欧盟委员会授权的标准化机构制定的标准,符合协调标准要求的产品受益于符合相应基本要求的假设。... 阅读全文
CE-MDR 欧盟 CE 认证 ISO 13485 医疗器械
CE 认证 | IVDR 代码的释义及使用
欧盟法规 2022-07-29在欧盟委员会实施条例 2017/2185 中,根据医疗器械法规 (EU)2017/745 和体外诊断法规 (EU)2017/746 指定公告机构的相应代码(Code)。这些代码主要由指定机构用于定义公告机构(NB)的审核范围,但 NB 也用于:描述 NB 工作人员的个人资格;描述评估设备所需的资格。 2021 年 7 月欧盟医疗器械协调小组(MDCG)发布了关于 IVDR 代码的说明文件。... 阅读全文
欧盟 CE 认证 CE-IVDR 欧盟法规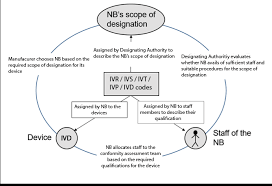
CE 认证 | MDR 代码的用途/分类/应用
欧盟法规 2022-07-28随着 MDR 的正式实施,各医疗器械制造商已开始逐步提交 MDR 申请,但是在提交过程中难免遇到不少 MDR code。 很多客户表示:对于纷繁复杂的 MDR code 很是陌生和无措。 那么,究竟该如何精确理解并选择 MDR code ?本文将从用途、分类和应用逐一做深度解析。... 阅读全文
CE-MDR 欧盟 CE 认证 欧盟法规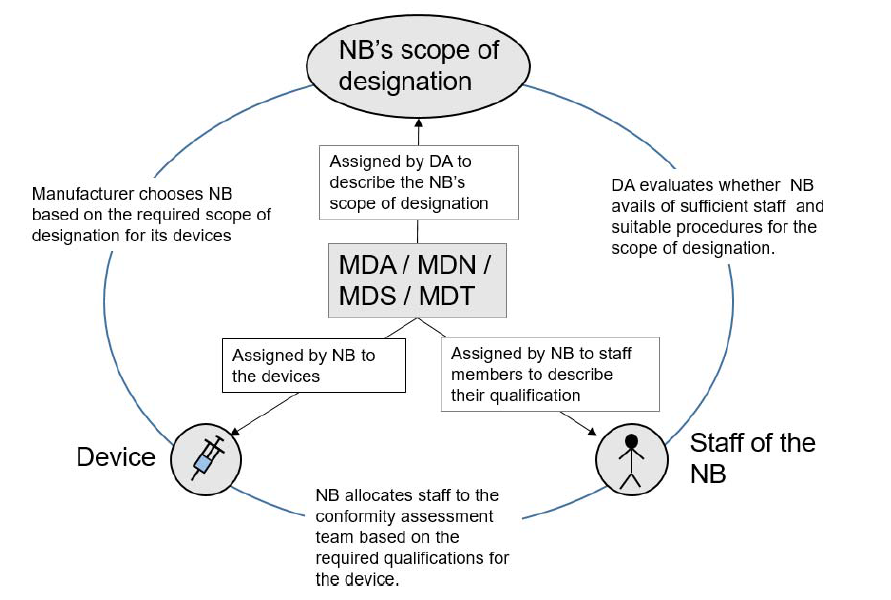
欧盟 MDR 风险管理要求与 ISO 14971:2019 的差异分析
欧盟法规 2022-07-28随着2019年ISO14971和相关技术报告(ISO/TR24971:2020)的发布,已经有很多关于该版本标准与前一版ISO标准(ISO14971:2007)和欧盟协调标准(ENISO14971:2012)要求的比较分析。此前没看到多少关于ISO14971:2019和MDR之间差异的分析。但因为ISO14971:2019在今年5月已成为MDR协调标准,所以这里将尝试做做分析。其他差异:... 阅读全文
CE-MDR 欧盟 CE 认证 欧盟法规
DoC符合性声明文件怎么写才符合欧盟及亚马逊要求? 模板来了!
欧盟法规 2022-07-27相信不少出口商品到欧盟的亚马逊卖家收到亚马逊的邮件,通知卖家要提供商品的符合性声明(Declaration of Conformity,下列简称「DoC」)。... 阅读全文
欧盟 CE 认证 DOC 自我声明
如何进行 CE 自我声明(DOC)?
欧盟法规 2022-07-27亚马逊CE符合性声明申请要求是什么?亚马逊要求商家供提符合其相关指令和统一标准的一致声明DOC,提供不了符合性声明亚马逊将封禁商家销售权限,要求上传CE符合性声明。所谓的符合性声明(declarationofconformity)简称DOC认证,可以用欧盟格式的企业《符合性声明书》。也就是说您的产品先要做符合亚马逊的标准检测报告。... 阅读全文
欧盟 CE 认证 欧盟法规 DOC 自我声明
欧盟CE认证机构介绍_什么是公告机构(Notified Body)?
欧盟法规 2022-07-26而CE认证的发证机构就是我们通常所说的公告机构-NotifiedBody,每个欧盟认可的公告机构都一个四位数的编号,厂家可以查询到目前从0001-3000三千家欧盟公告号机构详细信息,每家机构对应的指令和法规授权以及发证机构信息都可在该网站查询到。执行CE认证及证书签发的公告机构一般需要通过各成员国的认监委的认可,可以做EN50575标准检测并出报告的公告机构需要是ISO17025认可的实验室;... 阅读全文
NB 公告机构 欧盟 CE 认证
EMDN Code 和 GMDN Code 是什么?
欧盟法规 2022-07-12随着在MDR法规下欧洲医疗器械数据库(EUDAMED)各功能的逐步上线,欧盟在近期发布了关于欧洲医疗器械术语(EMDN)的常见问题指导,GMDN全球医疗器械术语系统(GMDN)是用于识别所有医疗器械产品的通用名称的目录。主要目的是向卫生当局和监管机构、医疗保健供应商、制造商和其他机构提供可用于交流医疗器械信息和支持患者安全的一套术语系统。... 阅读全文
欧盟法规
欧盟医疗器械法规MDR正式执行,这些变化需关注
欧盟法规 2022-01-19国产医药器械厂商在申请CE认证时需要注意的点有哪些?医疗器械厂商可以自主选择以旧指令MDD或新法规MDR申请CE证书;如果要申请欧盟认证则必须遵从新规MDR执行。即便是一些电商平台上进行销售的医用产品也需要通过严格的授权公告机构(NotifiedBody,也让目前获批的能够进行新规公告的机构数量大幅降低。医疗器械厂商应在其组织架构内至少配备一名负责监管合规的人员。... 阅读全文
CE-MDR 欧盟 CE 认证
