CE 认证 | IVDR 代码的释义及使用
2022-07-292021 年 7 月欧盟医疗器械协调小组(MDCG)发布了关于 IVDR 代码的说明文件。
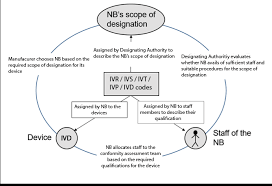
01-IVDR 代码概述
当制造商向 NB 提交申请时,应指明合格评定活动影响的设备和技术的类型,即识别适用的 Code。由 NB 验证是否能够进行此申请的评估,并确保其具备可用资源以开展合格评定活动。
在审查申请和合同签署后,NB 将分配合格的授权人员进行审核活动或产品审查。
下表概述不同类型代码及其在特定设备和资源分配方面的特征:
| 类型代码 | 分配代码给设备 | 合格评定人员分配 |
|---|---|---|
| IVR 反映设备设计和预期目的 | 每台设备只有 1 个代码。 此代码应根据法规 2017/2185 中的命令进行选择。 如果适用的 IVR 代码超过 1 个,则应选择列表中第一个代码。 | 分配参与技术文档审查的人员(例如产品审查员)或产品相关方面的审计。 |
| IVS 反映设备特定特性的水平代码 | 每个设备0到多个分配适用于设备的所有代码。 | 分配参与审查技术文件的人员。也可能适用于执行某些特殊过程审计工作的人员。 |
| IVT 描述技术的水平代码 | 每个设备1到多个分配描述主要生产技术的代码。 | 分配参与审核的人员(例:参与金属加工审核的现场审核员) |
| IVP 描述审查程序中相关知识的水平代码 | 每个设备1到多个分配描述主要审查程序相关知识的代码。 | 分配参与审查技术文件的人员。 |
| IVD 描述实验室和临床学科相关知识的水平代码 | 每个设备0到多个分配描述主要实验室和临床学科相关知识的代码。 | 分配参与审查技术文件的人员。 |
02-合格评定如何为 IVD 设备分配 Code?
1.IVR 代码
IVR 代码反映设备设计和预期目的,因此主要与参加技术文档审查的人员分配有关。NB 需要确保分配给该项目的人员有能力评估设备和技术。
IVR 代码指定体外诊断医疗应用领域(例如:IVR0401 设备,用于筛查/确认先天性/遗传性疾病)。
如果存在广泛的预期目的,则可能适用几种代码,此时应选择列表中第一个适用的代码。
IVD 设备“多种用途”相对常见,这种设备由不同“组件”构成,某些情况下,如果多重检测的组件是独立设备,则它们将分属于不同 IVR 代码。
该特殊情况下,如果单独使用一个 IVR 代码(即使与相关的 IVS、IVT 和 IVD 代码结合使用)无法适当涵盖设备的属性和风险,则可考虑分配多个 IVR 代码(参见下方示例)。因此,NB 需确保指派的人员有资格评估设备所有组件。
例:胃肠道疾病/症状的多重测定,将胃肠道病原体的测定、消化酶的测定、食物不耐受/敏感性的免疫化学标志物、炎症标志物或胃癌或结肠癌的标志物相结合。此 IVD 可能属于 IVR0300、IVR0500 和 IVR0600 代码。使用多个 IVR 代码是有必要的,以涵盖所有方面。
2.IVS 代码
IVS 代码是适用于具有特定特征的设备的水平代码。所有适用的代码都需要分配给设备,以确保审查团队具备符合性评定所需的全套资格。
IVS 代码主要与参与技术文档审查的人员分配有关,也可能适用对某些特殊过程进行审核的人员(例如用于审核环氧乙烷灭菌过程的人员的 IVS1005)。
如果设备所包含的软件用于设备使用或控制,则相关代码为 IVS1010 。
如果器械包含仪器、设备、系统或装置的一部分或集成到仪器、设备、系统或装置中,则应使用代码 IVS 1008(仪器、设备、系统或装置)。
例:血糖仪,用于自我检测的设备,包含用于测量血液中葡萄糖水平的内置软件,需分配以下代码:
IVS 1002 - 用于自检的设备,因为它将由最终用户直接使用;
IVS 1008 - 仪器、设备、系统或装置,因为它本身就是一个装置;
IVS 1010 - 包含软件/使用软件/由软件控制的设备,因为它包含软件。
3.IVT代码
IVT 代码同用于制造和提供设备的技术有关,最相关的是现场审核员的分配。
分配 IVT 代码除了考虑关键的上游生产步骤外,还应考虑到设备本身的生产。这意味着,即使考虑到医疗器械制造供应链中涉及的技术/过程时,许多代码可能适用,但只应考虑关键技术/生产过程的规范。
例:在免疫测定中,如果制造涉及的抗体在洁净室/受控环境中生产、纯化和固定,则应至少分配以下 IVT 代码:
IVT 2005 - 使用生物技术的体外诊断设备;
IVT 2008 - 在洁净室和相关受控环境中制造的体外诊断设备。
请注意:尽管制造商本身可能不会实际制造设备的所有部件,但有关制造步骤的 IVT 代码已分配给设备,因为它们在审核供应商/分包商时具有关联性。
4.IVP代码
IVP 代码同用于产品验证目的的检查程序知识有关。IVP 代码主要用于分配产品审核员。
例1:微生物鉴定采用乳胶凝集珠以检测特定的微生物抗原。
IVP 3001:需要有关凝集试验知识的体外诊断设备。
例2:通过流式细胞术进行免疫细胞表型(例如,检测急性髓系白血病)。
IVP 3006:需要流式细胞术知识的体外诊断设备。
5.IVD代码
IVD 代码涉及实验室和临床学科的知识,用于产品验证。IVD 代码与产品评审者分配相关。
委员会实施条例 2017/2185 (IVD 4001至4012)中列出的 IVD 代码,是指专门处理或使用相关 IVD 产品的实验室和临床学科,如细菌学、临床化学/生物化学或免疫学。
此外,可能有必要让委员会执行条例 2017/2185 中未列出的其他临床学科的专家参与其中,以治疗相关 IVD 检测到的疾病或病症。
