全球各地医疗器械 UDI 合规时间表
2022-08-03
什么是 UDI ?
唯一设备标识符(UDI)现在是在美国销售的医疗设备的一项要求,并且已逐步被欧盟和其他国家(地区)采用。 UDI 系统旨在为医疗保健用品提供者、制造商、授权的卫生当局、医院和机构以及个人消费者提供:
· 卫生部门更快地发现可能存在缺陷的医疗器械信息。
· 更快地访问召回信息,并查看当前库存。
· 通过一致记录的产品有效期减少医疗差错。
· 识别医疗设施中使用的任何假冒产品。
· 保证有关植入设备的信息是安全保留和可追踪的。
UDI 的时间表和截止日期因市场和产品而异,在一些国家(地区)已多次修订。本文介绍了各国(地区) UDI 的截止日期(更新至2022年7月26日前)。但请注意,这些日期可能会随着参与国(地区)调整其计划而改变。我们将继续更新相关信息。
UDI 要求有两个主要组件,标签和数据库注册。尽管努力协调各市场的标签和数据库要求,但有 UDI 采用计划的国家(地区)增加了针对市场的要求。
目前实行 UDI 要求的国家/地区有:
· 中国 UDI
· 美国 UDI
· 欧盟 UDI
· 澳大利亚 UDI
· 加拿大 UDI
· 巴西 UDI
· 印度 UDI
· 沙特阿拉伯 UDI
· 新加坡 UDI
· 日本 UDI
· 韩国 UDI
· 台湾 UDI
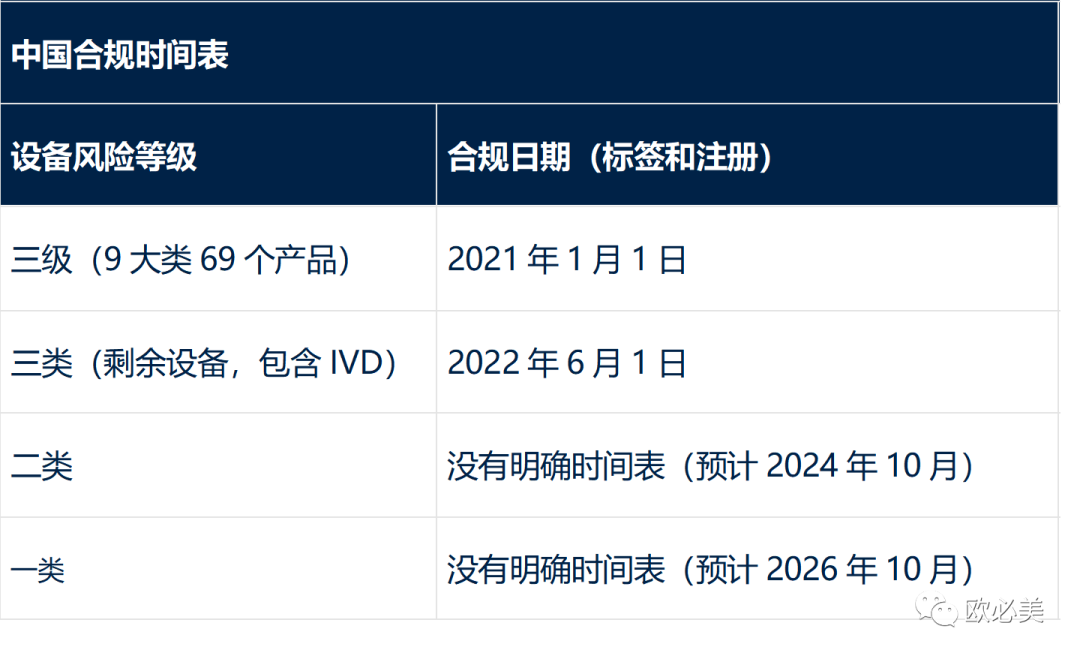
01 中国 UDI 要求
中国目前的要求包括对更复杂的设备进行 UDI 标记,还有更多的设备类别有待解决。除了标签要求外,中国还要求将 UDI 作为医疗器械注册的一部分进行记录。
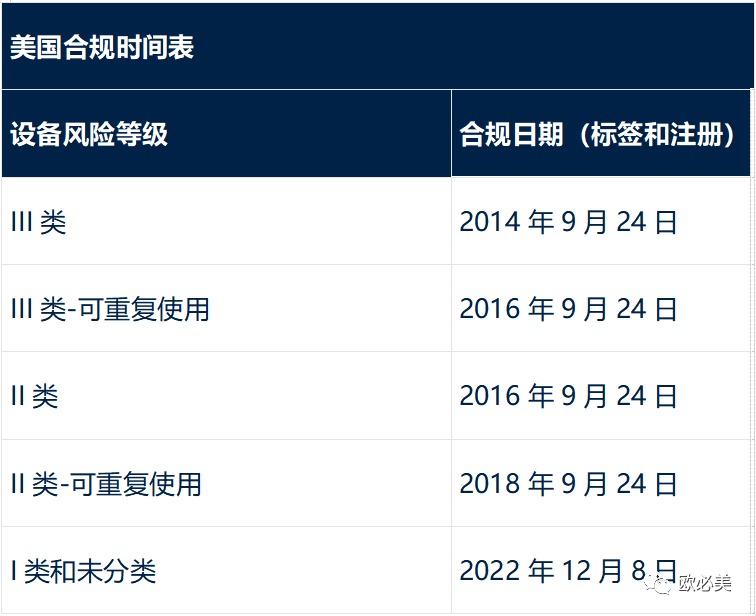
02 美国 UDI 要求
美国目前要求所有设备都符合标签和数据库要求。食品和药物管理局不打算在2022年12月8日之前对I类和非分类设备(植入式、支持生命或维持生命的设备(I/LS/LS)除外)实施G UDI D提交要求,无论其是否为消费健康产品。美国食品和药物管理局要求所有的 UDI 信息都必须输入美国特定的G UDI D数据库。
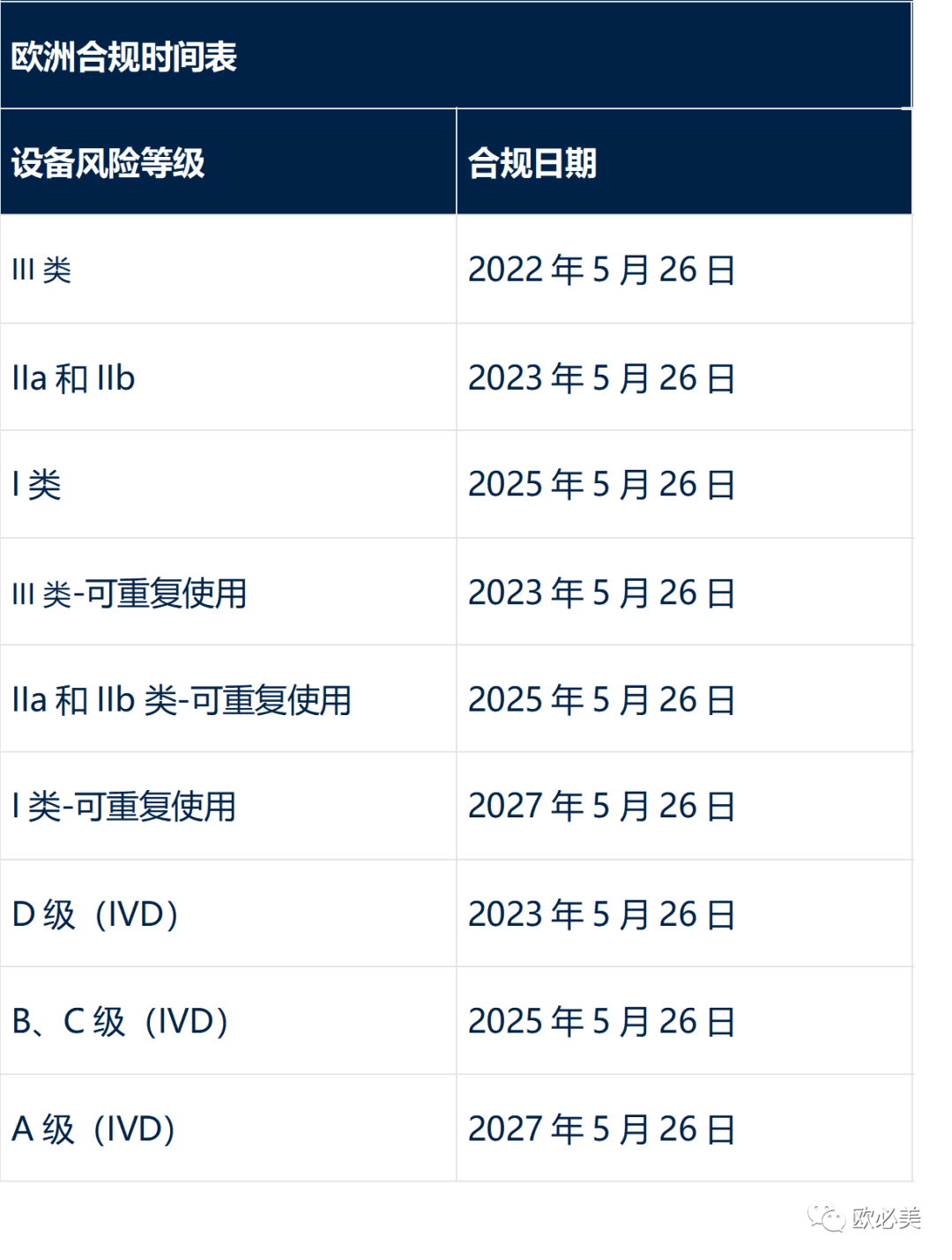
03 欧盟 UDI 要求
UDI 数据录入欧盟 UDI 模块的强制性合规预计在2026年年中要求完成。
UDI 标签的第一个合规截止日期是2022年5月26日,其他设备类别将在2027年5月26日之前推出。
04 澳大利亚 UDI 要求
澳大利亚治疗品管理局(TGA)已经成立了一个技术工作组来定义具体的 UDI 标签和数据要求,预计该法规的日期为2023年1月。然而,强制遵守可能要到下一年才会生效。有关实施时间表和进步可以在澳大利亚TGA网站。

05 加拿大 UDI 要求
加拿大卫生部已经提出了一个 UDI 框架,它紧密地基于国际来自IMDRF的 UDI 指南。目前的提案要求所有设备都贴上 UDI 标签,I类低风险设备除外。加拿大卫生部打算开发一个 UDI 数据库,或者修改现有的医疗设备活动许可证列表数据库(MDALL)以容纳 UDI 数据。预计与大多数国家一样,加拿大将根据需要添加少量额外的 UDI 数据属性。
06 巴西 UDI 要求
2022年1月10日,巴西卫生监管机构ANVISA要求设备 UDI 标签和数据库注册的法规RDC 591/2021生效。该条例要求根据风险等级滚动实施,并建立巴西 UDI 数据库。对于可重复使用的设备,其 UDI 信息直接放在产品上,下面的过渡期增加了两年。
UDI 数据库的详细信息以及相关的合规日期尚不可用。

* 2022年1月,随着这项法规的实施, UDI 标签在冠状动脉支架、药物洗脱冠状动脉支架以及髋关节和膝关节置换术中的植入物上成为强制性的。
有关详细信息,请参见 ANVISA UDI 指南。
07 印度 UDI 要求
2021年底,印度卫生和家庭福利部推迟了 UDI 在印度的实施要求,新的截止日期尚未出台。最初,2017年《医疗器械规则》第46条规定,要求在2022年1月1日之前,对批准在印度制造、销售、分销或进口的医疗器械贴上 UDI 标签。关于如何在设备上显示 UDI 的详细信息以及 UDI 需要包含的特定信息尚未发布。
08 沙特 UDI 要求
沙特阿拉伯自2020年10月1日起允许自愿 UDI 注册,但所有设备类别的强制遵守直到2022年9月1日才开始。这些要求适用于标签和数据库注册。
在合规日期之前进口的医疗器械可以在不满足 UDI 要求的情况下,在合规日期后的1年内进行分销。此例外不适用于直接标记(DM)要求,即设备本身上 UDI 的永久标记。
所有 UDI 要求:
· D类设备——沙特-D准备就绪1年后
· B/C类设备——沙特-D准备就绪2年后
· A级设备——沙特-D准备就绪3年后
· 对于直接标记要求-适用类别合规日期后2年
09 新加坡 UDI 要求
新加坡目前不要求遵守 UDI 标签或数据库注册法规。当要求生效时,新加坡将接受已在美国和欧盟销售的设备的 UDI 标签,否则 UDI 将需要遵守新加坡的所有HSA指南,包括与HSA指定的 UDI 发行实体合作。
新加坡还允许企业在以下列出的截止日期前,对进口的医疗器械给予6个月的宽限期。因此,例如,一家拥有高风险植入式设备的公司,要求在2022年11月进行 UDI 标记和注册,则可以在2023年5月1日之前继续销售不符合 UDI 标准的设备(允许在合规日期之前耗尽当地库存)。
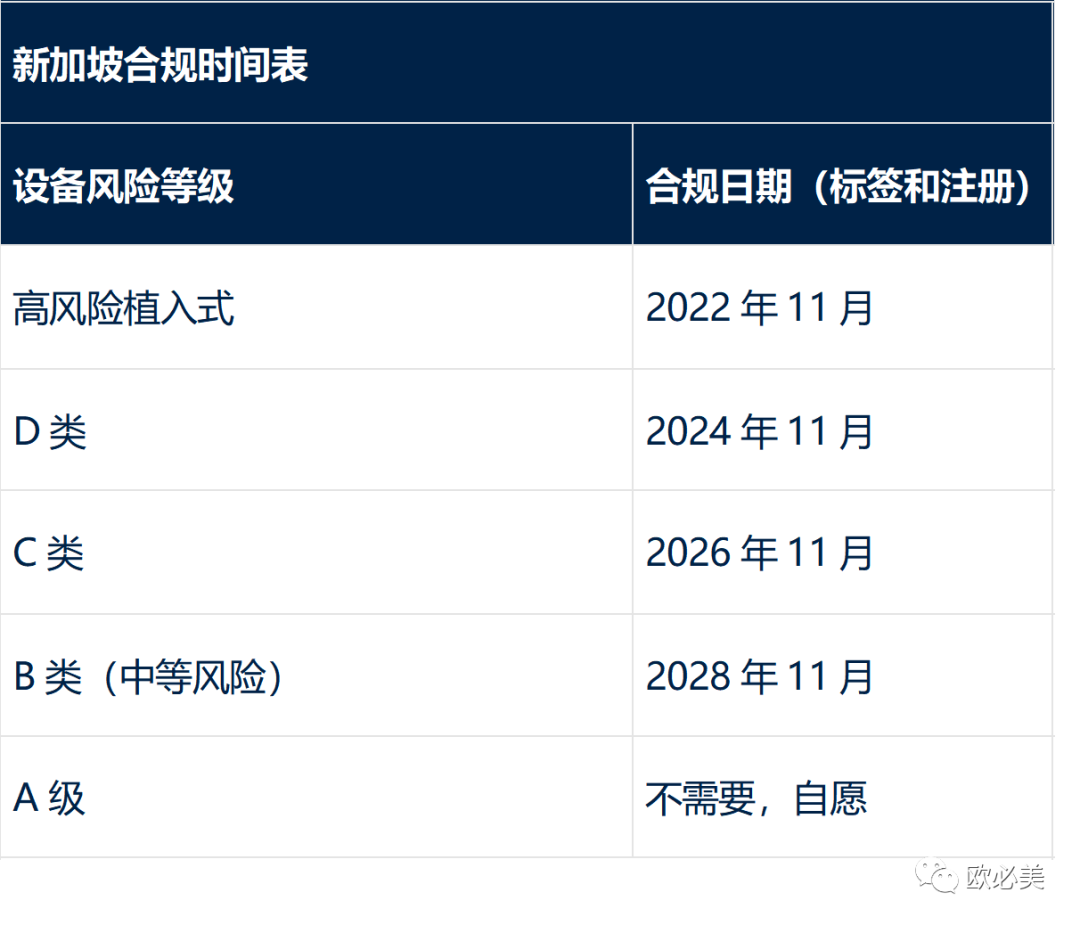
有关详细信息,请参见来自新加坡健康科学管理局的医疗器械 UDI 系统指南。
10 日本 UDI 要求
日本是标准化条形码的早期推动者,但仍在努力使其要求与全球 UDI 要求相协调。
11 韩国 UDI 要求
韩国已经对大多数设备类实施了 UDI 标签和数据库注册要求,只有一个类别尚未完成。作为引入 UDI 的一部分,韩国还要求制造商提供设备月度供应历史报告,要求从 UDI 合规日期起1年。
请注意,韩国法规中提到的是“综合医疗器械信息系统”,即IMDIS(即 UDI 数据库);以及“医疗器械标准代码”,即 UDI 代码本身。
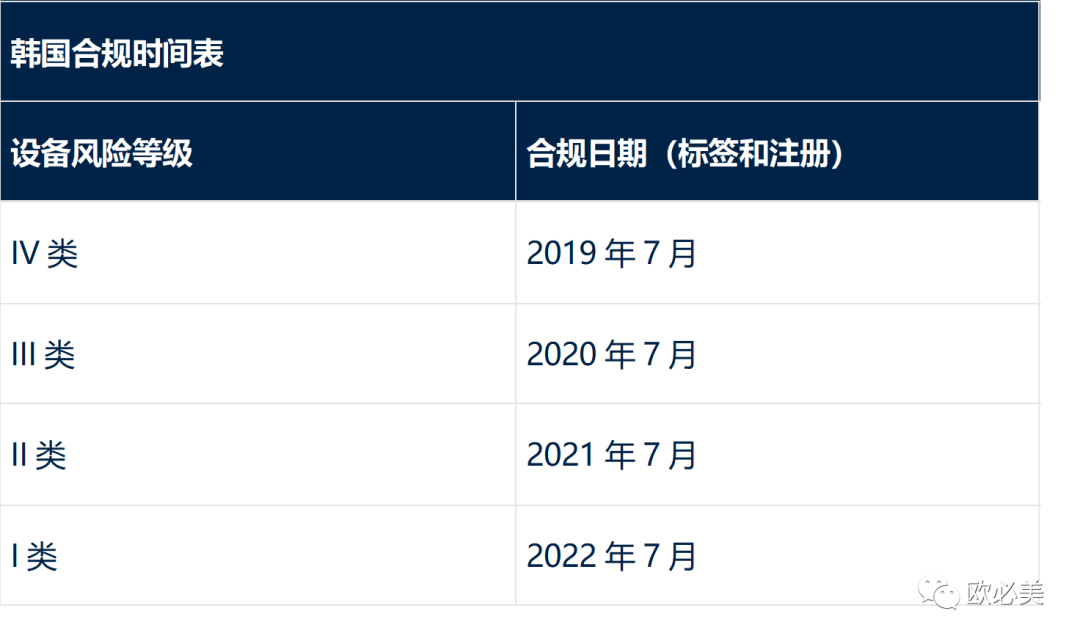
有关更多信息,请参阅更新的韩国法规: UDI 生成指南 ,第14330号医疗器械法以及KGMP第2016-156号法规。
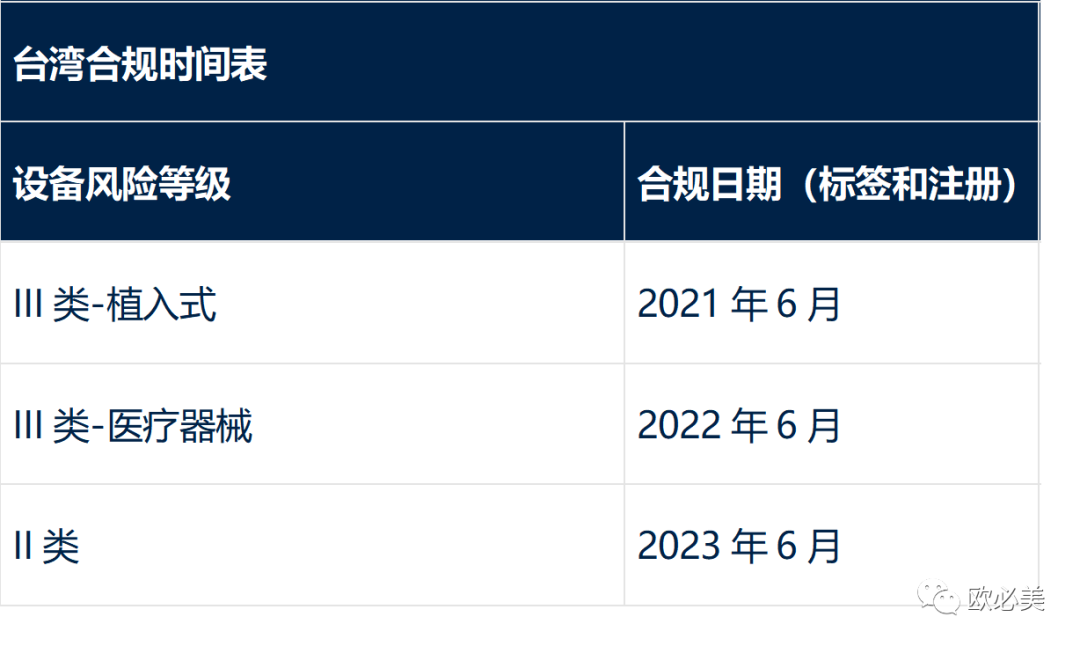
12 台湾 UDI 要求
台湾已开始分阶段实施 UDI ,包括标签和数据库报告要求。
特定国家 UDI 数据库 UDI 要求
每个国家都有自己的 UDI 数据库,对这些数据库中存储的数据有不同的要求。在不同的 UDI 数据库中,所需的数据存在重叠,但每个国家也有其所需的独特数据。
此外,各国要求 UDI -DI信息由“发布实体”提供。请注意,所有国家均接受GS1作为发布实体。
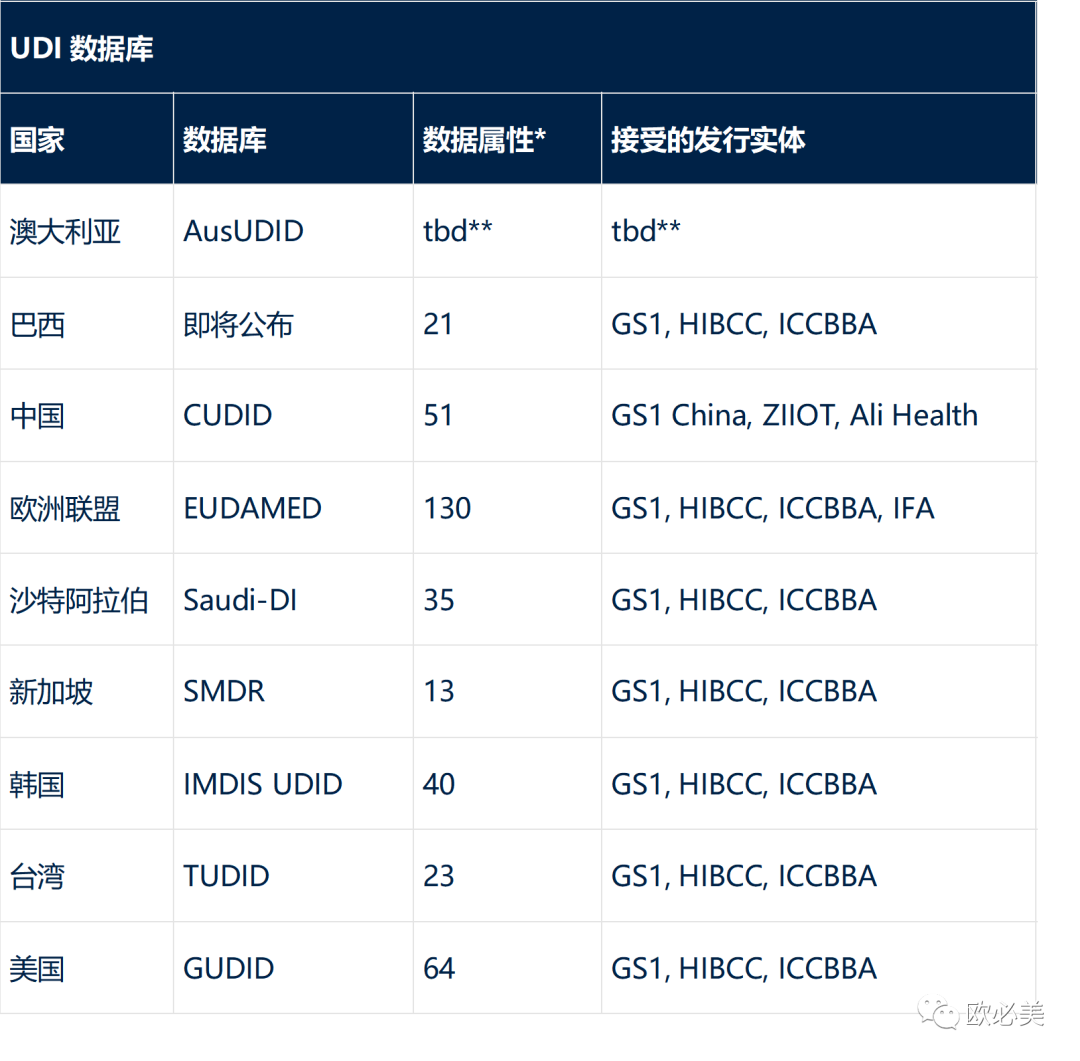
* 数据属性是基于国家 UDI 要求的近似值,包括强制、可选、强制(如果适用)和国家数据库自动生成的元素。