医疗器械「可用性」监管要求介绍
合规秘笈 2022-08-091、可用性工程在医疗器械中的应用医学实践中越来越多地使用医疗器械诊断和治疗患者。医疗器械可用性不良引起的使用错误已成为人们日益关注可用性的原因。许多未采用可用性工程过程开发的医疗器械难以学习和使用,现在缺乏技能的用户(包括患者自己)都在使用医疗器械,2、医疗器械可用性工程所涉及的标准3、医疗器械可用性测试的必要性医疗器械产品越来越先进,人因工程学和医疗器械可用性测试也逐渐被重视。... 阅读全文
标准解读
医疗器械产品技术要求的编写注意事项
合规秘笈 2022-08-05概述产品技术要求是保障医疗器械质量可控的重要技术资料,型号、规格及其划分说明产品技术要求中应明确产品型号、规格。应明确不同型号、规格的划分说明(推荐采用图示和/或表格的方式),导管直径、长度等信息必要时可作为产品描述性信息在技术要求附录体现,其他如产品工程图等无需在技术要求中列明。产品技术要求内容引用国家标准、行业标准,产品技术要求中所引用标准应保证为最新版。... 阅读全文
典型案例 中国法规
全球各地医疗器械 UDI 合规时间表
合规秘笈 2022-08-03唯一设备标识符(UDI)现在是在美国销售的医疗设备的一项要求,UDI 系统旨在为医疗保健用品提供者、制造商、授权的卫生当局、医院和机构以及个人消费者提供:识别医疗设施中使用的任何假冒产品。... 阅读全文
标准解读 UDI 唯一器械标识
天津两家化妆品企业因未及时上传功效摘要,被处罚
合规秘笈 2022-07-26发现在执法人员的备案系统账号及国产普通化妆品备案信息数据查询界面中,当事人分别于2022年4月15日、2022年4月21日编制了上述2款化妆品功效宣称依据的摘要,现场登录国家药品监督管理局普通化妆品备案管理系统(以下简称备案系统)及国产普通化妆品备案信息数据查询界面,发现在执法人员及当事人创建的备案系统账号中,当事人现场亦无法提供关于上述产品的化妆品功效宣称依据的摘要。... 阅读全文
典型案例 产品注册许可 化妆品 中国法规
医疗器械飞检时的「十要」与「十不要」
合规秘笈 2022-07-25如果你不知道,可放弃回答并提出让更了解的人回答;如果问题的回答需要从专家的角度回答,请专家回答。如果你承诺了一个问题,一定要完成它,切记不要说谎。... 阅读全文
典型案例 医疗器械
如何编写医疗器械说明书?(附模板)
合规秘笈 2022-07-19本文对医疗器械上市前和上市后的相关配套法规文件将以医疗器械产品生命周期内的注册、生产、经营、使用、监督管理等环节为框架,什么是医疗器械说明书《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)第三条明确规定:医疗器械说明书主要包括的内容依据《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)第十条,由消费者个人自行使用的医疗器械还应当具有安全使用的特别说明;... 阅读全文
医疗器械 中国法规 中国 NMPA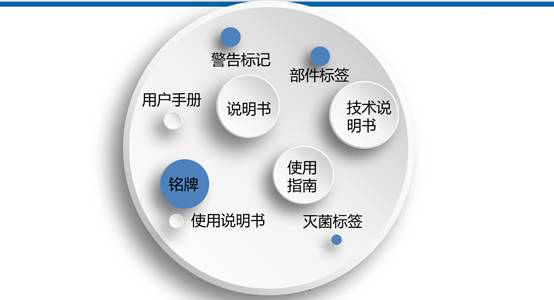
医疗器械和体外诊断器械GMDN代码查询服务
合规秘笈 2022-07-12GMDN代码是CE、FDA、MDSAP等认证或注册时必需的一项重要内容。很多客户对此不太了解,为查找该代码而大费周折,为此,奥斯曼可为您提供GMDN代码查询服务。... 阅读全文
欧盟法规
SARS-CoV-2诊断测试的常见问题解答
合规秘笈 2020-03-17我将根据《临床实验室和食品和药物管理局工作人员立即生效指南》中概述的新政策提供我自己的测试:在获得针对冠状病毒病的紧急使用授权之前已通过CLIA进行高复杂性测试的实验室的诊断测试政策-2019年公共卫生紧急事件期间。已通过CLIA认证进行了高度复杂性测试的实验室诊断测试政策,FDA认为CDC的EUA授权测试可以在以下旨在检测RNA病毒的仪器上进行。... 阅读全文
美国 FDA 注册 欧盟 CE 认证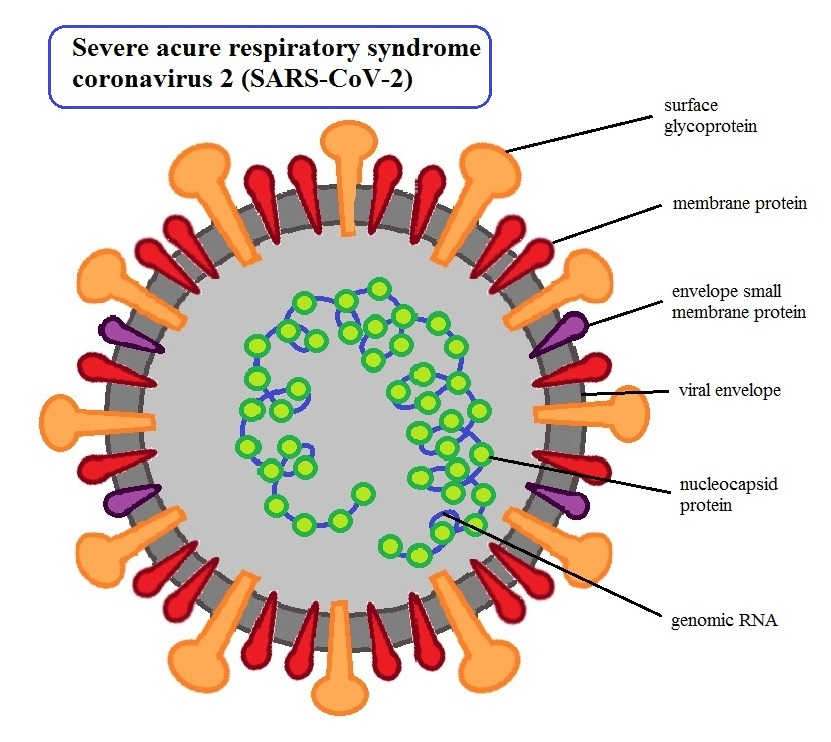
口罩和额温枪的相关分析
合规秘笈 2020-03-17这里面尤以口罩、防护服、额温枪、新冠病毒检测试剂盒/核酸检测仪器/样本保存液、消毒液等为代表的典型性产品。本段内容从口罩的用途出发来分析CE、FDA具体要求,参考引用《浙江省紧急防护民用口罩生产指南(暂行)的通知》(具体通知内不再引用,依据口罩的标准以及实际用途大体可分为医用和工业防护用两类(以欧盟及美国法规为参考):... 阅读全文
口罩 额温枪