医疗器械「可用性」监管要求介绍
2022-08-09
1、可用性工程在医疗器械中的应用
医学实践中越来越多地使用医疗器械诊断和治疗患者。医疗器械可用性不良引起的使用错误已成为人们日益关注可用性的原因。许多未采用可用性工程过程开发的医疗器械难以学习和使用,在医疗器械比较简单的时代,用户也许能应对不明确的、难以使用的用户接口;随着医疗卫生保健的发展,现在缺乏技能的用户(包括患者自己)都在使用医疗器械,医疗器械也变得更加复杂。设计可用的医疗器械是有挑战性的工作,然而许多组织仅仅将其视为"常识"。为实现适当的(安全的)可用性,用户接口的设计需要完全不同于接口技术实现的一组技能。可用性工程过程旨在达到合理的可用性,依次尽可能减少使用错误和尽可能降低与使用有关的风险。一些(但不是全部)错误的使用形式可由制造商负责控制。
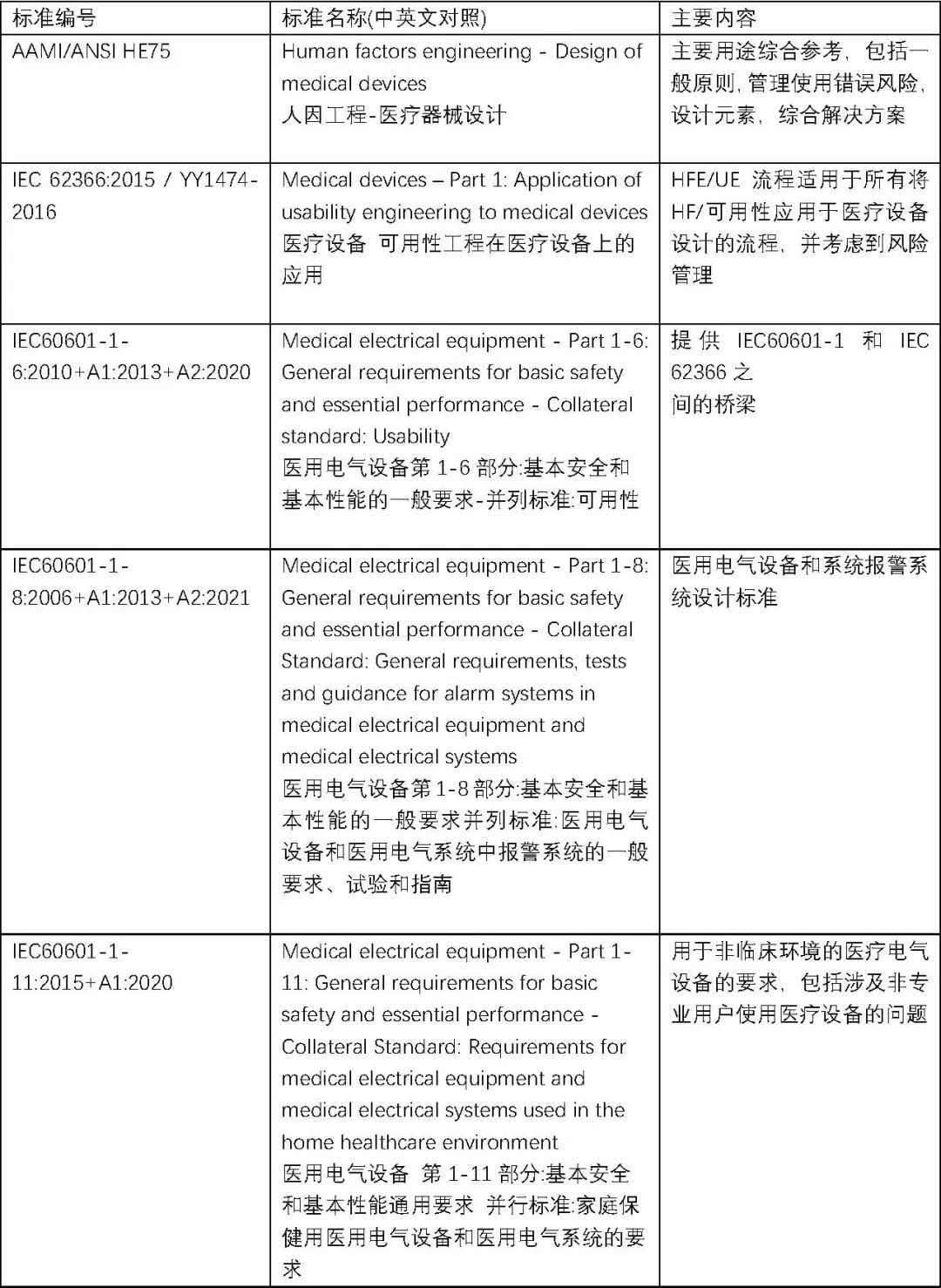
2、医疗器械可用性工程所涉及的标准
3、医疗器械可用性测试的必要性
医疗器械产品越来越先进,功能强大、品种繁多。新产品层出不穷,面对五花八门、形式多样的医疗设备,如何保证医护人员与患者快速准确地使用产品变得尤为重要。随着使用错误而导致患者伤亡的案例日益增多,人因工程学和医疗器械可用性测试也逐渐被重视。
可用性测试可以发现使医疗器械的操作更简单、更安全、更有效和好用的改进机会。而这种人机交互质量的改善将使得与给定器械相关的每一个人受益,尤其是制造商和最终用户。医疗器械可用性测试目的是防止人们因为使用失误而受伤害或者死亡。例如,按错了一个按钮、读错一个数据、放错了一个配件、跳过了一个步骤,或者在使用医疗器械时忽视了一条警告信息,而造成了人员伤亡。虽。医疗器械可用性做的比较好,可以获得比较客观的潜在收益,例如较快的上市时间、较简单的用户手册和相关学习工具、改进销售情况、降低培训和支持要求、延长市场寿命、减少受到责任赔偿、提高用户满意度等等。
法规要求,今年从欧美地区到国内的法规都要求进行医疗器械可用性测试。

