什么是协调标准
欧盟法规 2022-10-24制造商、其他经济运营商或合格评定机构可使用协调标准来证明产品、服务或工艺符合相关的欧盟法规。标准是包含技术信息以一致方式指导或定义实践的已发布文件,医疗器械法规下的协调欧洲标准由欧洲标准化组织根据EC按法规(EU)1025/2012发布的标准化请求制定。协调标准是由欧盟委员会授权的标准化机构制定的标准,符合协调标准要求的产品受益于符合相应基本要求的假设。... 阅读全文
CE-MDR 欧盟 CE 认证 ISO 13485 医疗器械
有源医疗器械有效期的评价方法
中国法规 2022-08-02有源医疗器械可实现对疾病的诊断、预防、监护和治疗等功能,为了在临床使用中维持上述功能,医疗器械注册申请人/注册人需确定产品的使用期限。 在该期限内,除了应保证产品安全使用,也应保证产品有效使用。同样,在该期限内,意味着产品采用的所有风险控制措施仍然有效,已知剩余风险依然在可接受范围内。... 阅读全文
医疗器械 中国法规 中国 NMPA
医疗器械出口新加坡合规攻略
多国法规 2022-07-27医疗器械(体外诊断设备是作为医疗器械的一个子集)是由新加坡卫生科学局(HSA)下属的医疗器械部门负责监管的。体外诊断产品(IVD)视为医疗器械(MD)的子集。新加坡医疗器械的分类规则以全球医疗器械协调工作组(GHTF)建议为基础,BCD类必须通过HSA进行注册。参考国批准如果医疗器械获得以下一个或多个海外参考监管机构的市场授权。... 阅读全文
医疗器械 其他国家 新加坡注册
从大量实例深入体会 GMP 法规
中国法规 2022-07-261.4.1技术、生产、质量管理部门负责人应当熟悉医疗器械法律法规,应当有能力对生产管理和质量管理中实际问题作出正确判断和处理;质量管理部质检人员职位任职资格文件(KP3-06-01-R202)规定,对兼职检验员进行监督管理;无产品制造人员具备相应资格或经过针对性的培训记录;设备篇3.2.1生产设备的设计、选型、安装、维修和维护应当符合预定用途;... 阅读全文
典型案例 医疗器械 中国法规 中国 NMPA GMP 体考
关于《医疗器械生产许可证》的相关问答
中国法规 2022-07-26《医疗器械生产许可证》是什么?《医疗器械生产许可证》是从事第二类、第三类医疗器械生产活动的企业,《医疗器械生产许可证》有副本吗?《医疗器械生产许可证》分为正本和副本。《医疗器械生产许可证》有效期多长时间?《医疗器械生产许可证》有效期为5年。哪些企业需要申请《医疗器械生产许可证》?从事第二类、第三类医疗器械生产活动的企业,依法取得《医疗器械生产许可证》。申请《医疗器械生产许可证》需要多长时间?... 阅读全文
产品注册许可 医疗器械 中国法规 生产许可证 中国 NMPA
医疗器械飞检时的「十要」与「十不要」
合规秘笈 2022-07-25如果你不知道,可放弃回答并提出让更了解的人回答;如果问题的回答需要从专家的角度回答,请专家回答。如果你承诺了一个问题,一定要完成它,切记不要说谎。... 阅读全文
典型案例 医疗器械
NMPA | 射频美容类器械、灸疗类医疗器械分类界定指导原则
中国法规 2022-07-22射频美容类医疗器械属性界定 符合《医疗器械监督管理条例》有关医疗器械含义的射频美容类产品,达到局部浅表温和加热、改善血液循环等目的的射频美容类产品,(二)预期使用射频能量作用于人体(包括但不限于皮肤组织及皮下深层软组织等),且可能会对人体造成潜在的影响或损伤(如组织即刻收缩反应、组织变性、细胞凋亡等)的射频类美容产品,分类界定 ... 阅读全文
产品注册许可 医疗器械 医用 中国法规 中国 NMPA
美国 FDA 突破性器械项目及进展情况简介
美国法规 2022-07-19突破性器械项目取代了医疗器械加速途径(ExpeditedAccessPathway)和优先审查(PriorityReview),前期获得加速途径指定的医疗器械即被认为符合突破性器械项目。六、突破性器械项目指定申请中包含的内容申请资料应包括产品描述信息、适应症、监管情况、阐述产品满足突破性器械项目的理由,七、突破性器械项目指定结果的告知方式FDA在收到请求后30天内提供提出补充资料要求。... 阅读全文
美国 FDA 注册 医疗器械
如何编写医疗器械说明书?(附模板)
合规秘笈 2022-07-19本文对医疗器械上市前和上市后的相关配套法规文件将以医疗器械产品生命周期内的注册、生产、经营、使用、监督管理等环节为框架,什么是医疗器械说明书《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)第三条明确规定:医疗器械说明书主要包括的内容依据《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)第十条,由消费者个人自行使用的医疗器械还应当具有安全使用的特别说明;... 阅读全文
医疗器械 中国法规 中国 NMPA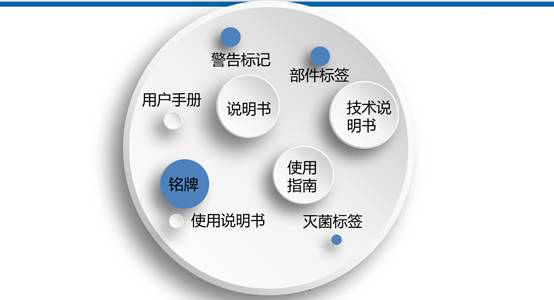
东南亚各国新冠自测试剂盒注册要求
多国法规 2022-03-30泰国当地法人(2) :协调测试(3) :需要获得认可机构(来自美国、欧盟、加拿大、澳大利亚或日本)的批准2. 注册周期≥6个月3.注册流程;(1)韩国持证人;韩国当地法人 :注册周期≥6个月;见指南文件新加坡只有卫生部(MOH)确定有临床需求的自我测试才有资格获得HSA在大流行特殊访问途径(PSAR)下的评估:(1)菲律宾持证人;菲律宾当地法人 :... 阅读全文
产品注册许可 医疗器械
