全球各地医疗器械 UDI 合规时间表
合规秘笈 2022-08-03唯一设备标识符(UDI)现在是在美国销售的医疗设备的一项要求,UDI 系统旨在为医疗保健用品提供者、制造商、授权的卫生当局、医院和机构以及个人消费者提供:识别医疗设施中使用的任何假冒产品。... 阅读全文
标准解读 UDI 唯一器械标识
有源医疗器械有效期的评价方法
中国法规 2022-08-02有源医疗器械可实现对疾病的诊断、预防、监护和治疗等功能,为了在临床使用中维持上述功能,医疗器械注册申请人/注册人需确定产品的使用期限。 在该期限内,除了应保证产品安全使用,也应保证产品有效使用。同样,在该期限内,意味着产品采用的所有风险控制措施仍然有效,已知剩余风险依然在可接受范围内。... 阅读全文
医疗器械 中国法规 中国 NMPA
CE 认证 | IVDR 代码的释义及使用
欧盟法规 2022-07-29在欧盟委员会实施条例 2017/2185 中,根据医疗器械法规 (EU)2017/745 和体外诊断法规 (EU)2017/746 指定公告机构的相应代码(Code)。这些代码主要由指定机构用于定义公告机构(NB)的审核范围,但 NB 也用于:描述 NB 工作人员的个人资格;描述评估设备所需的资格。 2021 年 7 月欧盟医疗器械协调小组(MDCG)发布了关于 IVDR 代码的说明文件。... 阅读全文
欧盟 CE 认证 CE-IVDR 欧盟法规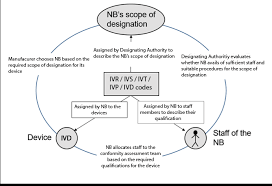
CE 认证 | MDR 代码的用途/分类/应用
欧盟法规 2022-07-28随着 MDR 的正式实施,各医疗器械制造商已开始逐步提交 MDR 申请,但是在提交过程中难免遇到不少 MDR code。 很多客户表示:对于纷繁复杂的 MDR code 很是陌生和无措。 那么,究竟该如何精确理解并选择 MDR code ?本文将从用途、分类和应用逐一做深度解析。... 阅读全文
CE-MDR 欧盟 CE 认证 欧盟法规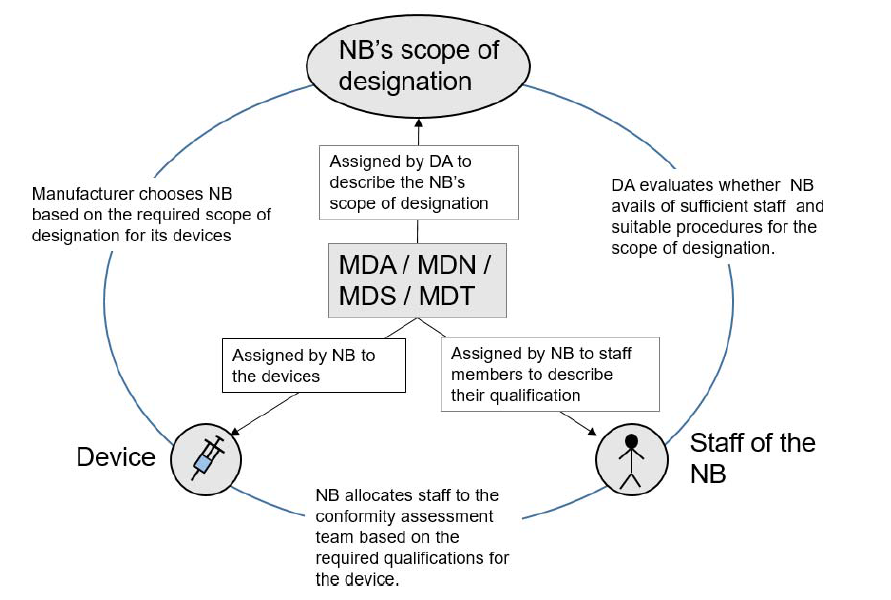
ISO22716认证是什么?化妆品质量管理体系你知道吗?
体系标准 2022-07-28化妆品国际认证ISO22716标准——化妆品良好操作规范将逐渐发展成为化妆品出口标准新趋势,公告该指南正式成为欧盟化妆品法规(EC)No1223/2009的GMP协调标准,2007即表示符合了欧盟化妆品法规的GMP要求。该法规对化妆品的安全性提出了更加严格的要求,二、通过ISO22716化妆品认证的优势1、确保产品安全2、提升公司产品质量管理水平3、降低产品对消费者造成的伤害或死亡的风险。... 阅读全文
ISO 体系 ISO 22716
ISO 15378 - 验证- 主要的医药产品包装材料
体系标准 2022-07-28ISO 15378 认证是药包材企业通向国际市场的门槛之一,是出口型药包材企业通常需要获得的通行证。在国内,ISO 15378 认证是一个偏冷门的体系认证。... 阅读全文
ISO 体系 ISO 15378
什么是 ISO 9001?
体系标准 2022-07-28但已实施ISO9001质量管理标准的公司数量仍然在全球范围内保持稳定。整个文档定义了一套指导企业如何创建产品或服务并将其交付给顾客的内部规则。质量管理体系必须结合您的企业和您所提供的产品或服务的需求量身打造,定义质量管理体系范围以及确定过程及其相互作用的要求。——领导作用要求涵盖了最高管理者在实施质量管理体系方面发挥作用的必要性。... 阅读全文
ISO 体系 ISO 9001
FDA提案修订21 CFR第820部分,对齐ISO 13485:2016
美国法规 2022-07-28这项新提案旨在调整和协调当前的医疗器械法规21CFR820和ISO13485:FDA一直有兴趣寻求与ISO13485要求的协调以对应全球QMS的要求,名为质量管理体系法规(QMSR)的提案新规则/法规包括了附加定义、概念澄清和附加要求等内容,FDA对所有提议的变更给出了透明的概述,建议销往美国的医疗器械制造商阅读此提案的新规则。... 阅读全文
CFR 820 美国法规
什么是QSR 820?
美国法规 2022-07-28是FDA法规中对于医疗器械质量管理体系的相关要求。医疗器械制造商以及拟将产品销往美国的外国(人用)医疗器械制造商必须遵守的质量管理体系法规QSR820。是多数医疗器械在美国上市之前必须遵守、上市之后随时可能抽查的基本要求。监管方式FDA不会像NMPA一样在发放许可证之前先进行体系考核。FDA对于所有的企业的体系考核是通过后续的抽查形式来进行监控的,全球的医疗器械注册企业都会有被抽查到的可能性。... 阅读全文
QSR 820 美国法规

