天津两家化妆品企业因未及时上传功效摘要,被处罚
合规秘笈 2022-07-26发现在执法人员的备案系统账号及国产普通化妆品备案信息数据查询界面中,当事人分别于2022年4月15日、2022年4月21日编制了上述2款化妆品功效宣称依据的摘要,现场登录国家药品监督管理局普通化妆品备案管理系统(以下简称备案系统)及国产普通化妆品备案信息数据查询界面,发现在执法人员及当事人创建的备案系统账号中,当事人现场亦无法提供关于上述产品的化妆品功效宣称依据的摘要。... 阅读全文
典型案例 产品注册许可 化妆品 中国法规
2022年 7 月提醒:CE资质出口英国已进入最后一年过渡期
多国法规 2022-07-26医疗器械投放到英国市场的制造商可以使用新的市场途径和产品标记(UKCA标记)所有医疗设备,在投放英国市场之前都需要在MHRA注册英国境外的医疗器械制造商并希望将器械投放到英国市场,英国公告机构无法颁发CE证书CE标志将继续在英国得到认可,直到2023年6月30日由欧盟认可的公告机构颁发的证书将继续在英国市场有效,在北爱尔兰市场上销售的设备需要CE标志或CEUKNI标志。... 阅读全文
英国 UKCA
医疗器械飞检时的「十要」与「十不要」
合规秘笈 2022-07-25如果你不知道,可放弃回答并提出让更了解的人回答;如果问题的回答需要从专家的角度回答,请专家回答。如果你承诺了一个问题,一定要完成它,切记不要说谎。... 阅读全文
典型案例 医疗器械
NMPA | 射频美容类器械、灸疗类医疗器械分类界定指导原则
中国法规 2022-07-22射频美容类医疗器械属性界定 符合《医疗器械监督管理条例》有关医疗器械含义的射频美容类产品,达到局部浅表温和加热、改善血液循环等目的的射频美容类产品,(二)预期使用射频能量作用于人体(包括但不限于皮肤组织及皮下深层软组织等),且可能会对人体造成潜在的影响或损伤(如组织即刻收缩反应、组织变性、细胞凋亡等)的射频类美容产品,分类界定 ... 阅读全文
产品注册许可 医疗器械 医用 中国法规 中国 NMPA
唯一设备标识:FDA 关于 I 类和未分类设备以及某些需要直接标记的设备的合规日期的政策
美国法规 2022-07-21FDA独特的设备识别系统旨在通过分销和使用充分识别设备。其要求旨在根据主要基于设备分类的既定合规日期在七年内分阶段实施。为I类和非分类设备(植入式、生命支持或生命维持(I/LS/LS)设备除外)确定的合规日期为:标签(21CFR801.20、21CFR801.50)和全球唯一设备识别数据库(GUDID)数据提交(21CFR830.300);本指南描述了FDA对I类和未分类设备执行这些要求的意图。... 阅读全文
UDI 唯一器械标识 美国法规
美国 FDA 食品企业注册要求
美国法规 2022-07-20我国有众多食品企业的产品输往美国,为帮助我国输美食品企业更好地理解美国食品企业注册的流程和需要重点关注的问题,以避免因注册问题引起的产品被扣留风险,保证我国食品更平稳顺畅地输入美国,现对美国FDA相关食品企业注册法规要求进行简要介绍。... 阅读全文
美国 FDA 注册 美国代理人 FDA 食品 美国法规 食品
美国 FDA 突破性器械项目及进展情况简介
美国法规 2022-07-19突破性器械项目取代了医疗器械加速途径(ExpeditedAccessPathway)和优先审查(PriorityReview),前期获得加速途径指定的医疗器械即被认为符合突破性器械项目。六、突破性器械项目指定申请中包含的内容申请资料应包括产品描述信息、适应症、监管情况、阐述产品满足突破性器械项目的理由,七、突破性器械项目指定结果的告知方式FDA在收到请求后30天内提供提出补充资料要求。... 阅读全文
美国 FDA 注册 医疗器械
如何编写医疗器械说明书?(附模板)
合规秘笈 2022-07-19本文对医疗器械上市前和上市后的相关配套法规文件将以医疗器械产品生命周期内的注册、生产、经营、使用、监督管理等环节为框架,什么是医疗器械说明书《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)第三条明确规定:医疗器械说明书主要包括的内容依据《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)第十条,由消费者个人自行使用的医疗器械还应当具有安全使用的特别说明;... 阅读全文
医疗器械 中国法规 中国 NMPA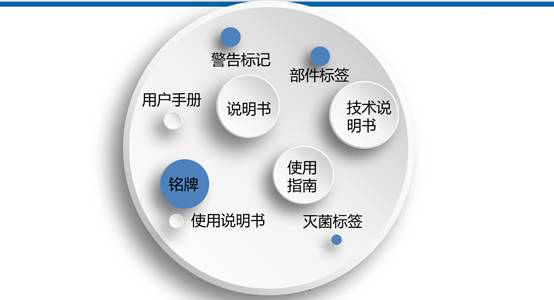
当EUA被撤销或者被终止时,生产商或者进口商该怎么做?
美国法规 2022-07-19美国食品和药品监督管理局(FDA)宣布撤销费森尤斯·卡比(美国)公司的Propoven2%乳剂产品的紧急使用授权(EmergencyUseAuthorization,EUA政策允许生产商、进口商和分销商临时将其产品推向市场以应对日益严重的新冠疫情,FDA有权利在紧急情况下批准使用之前未经批准的产品。... 阅读全文
典型案例 美国代理人 警告信
医疗器械和体外诊断器械GMDN代码查询服务
合规秘笈 2022-07-12GMDN代码是CE、FDA、MDSAP等认证或注册时必需的一项重要内容。很多客户对此不太了解,为查找该代码而大费周折,为此,奥斯曼可为您提供GMDN代码查询服务。... 阅读全文
欧盟法规
