沙特医疗器械认证简介
2022-07-06

沙特阿拉伯王国 (KSA) 是 GCC(海湾合作委员会(GCC),六个中东国家-沙特阿拉伯、科威特、阿拉伯联合酋长国、卡塔尔、巴林和阿曼的政治和经济联盟)地区最大的市场,大约 98% 的医疗器械依赖国际进口。
一、主管机构和核心法规
沙特食品药品管理局 (SFDA) 成立于 2003 年,负责监管食品和药品,以及医疗器械和体外诊断设备。目前使用2008 年第 1-8-1429 号临时法规法令。其定义了“医疗器械”是指制造商打算单独或组合用于人类的任何仪器、装置、器具、机器、植入物、体外试剂或校准器、软件、材料又或其他类似及相关物品 :
用于诊断、预防、监测、治疗或缓解疾病;
用于诊断、监测、治疗、减轻或补偿伤害/残障;
研究、替换、改变或支持生理的解剖结构;
支持或维持生命;受孕控制;医疗器械消毒。
二、产品分类
国家食品药品监督管理局(SFDA)推出了医疗器械和产品分类系统(MDC),旨在促进和加快医疗器械和产品分类程序,以电子方式申请注册。在国家食品药品监督管理局及其子部门、海关、港口和其他政府机构的不同部门之间,以及供应商和分销商以及企业医疗器械之间,达到便于管理,高效便捷的目的。
MDS–G42医疗器械指南中,明确沙特将医疗器械分为4类(与欧盟类似):
1. 低风险:Class A/ Class A灭菌/Class A(测量)/Class A重复使用手术器械
2. 中低风险:Class B
3. 中高风险:Class C
4. 高风险: Class D
IVD分类:
1. 个人风险低,公共卫生水平低风险:Class A
2. 个人风险中等,公共卫生水平低风险:Class B
3. 个人风险高,公共卫生水平中等风险:Class C
4. 个人风险高,公共卫生水平高风险: Class D
根据沙特阿拉伯医疗器械法规,SFDA接受将主型号、相关型号、附件作为组合到一个单独申请中。在沙特阿拉伯销售之前,设备必须在参考国家(澳大利亚、加拿大、欧洲、日本或美国)获得授权。对于参考国家的边界产品和不同类别的器械,SFDA有正式分类的规定(可咨询奥斯曼认证咨询机构)。
三、认证模式
沙特阿拉伯医疗器械注册要求因器械类别而异,有两种医疗器械审批途径,例如:
1. 医疗器械国家注册处 (MDNR) 列示
I 类普通的医疗器械需要在医疗器械国家注册处 (MDNR) 中列出,作为在 KSA 销售该设备的先决条件。此路径需要基本产品和制造商信息、QMS 证明、参考国家批准、IFU、标签和销售材料以及其他要求。SFDA通过该途径批准医疗器械的时间为4个工作日,有效期为3年。
2. 医疗器械上市许可 (MDMA)
所有其他类别的设备必须获得作为医疗设备上市许可 (MDMA) 颁发的医疗设备认证,才能在 KSA 销售设备。通过该途径获得 MDMA 批准的 SFDA 医疗器械注册时间通常为 35 天,许可证有效期为原始许可证有效期或未定义的原始许可证有效期为 3 年。
四、审核流程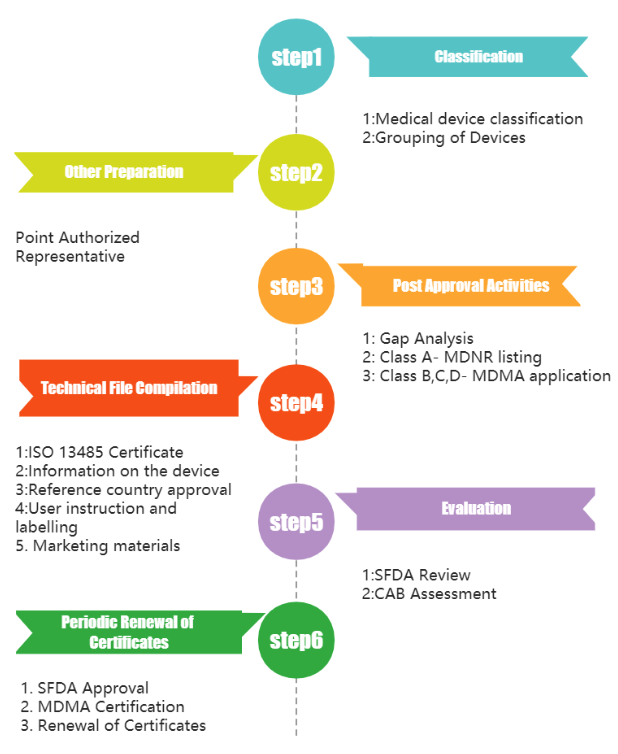
1. 在沙特阿拉伯销售之前,设备必须在参考国家(澳大利亚、加拿大、欧洲、日本或美国)获得批准
2. 任命沙特阿拉伯授权代表
所有在沙特没有法人实体或实体存在的外国制造商都必须拥有医疗器械授权代表 (AR) 来销售这些器械。该实体必须拥有通过医疗器械建立 (MDEL) 系统颁发的 AR 许可证,才能充当 AR。
3. 通过 AR 提交医疗器械销售许可 (MDMA) 申请。此申请将包括:设备标签、IFU 以及英语和阿拉伯语的宣传材料。它还需要包括参考市场的批准文件和英文认证。
4. SFDA 审核申请,然后合格评定机构 (CAB) 对申请进行严格的技术审查。很多时候,注册申请会经历多轮审核。
5. CAB审核后,向 SFDA 提出建议,SFDA 将做出最终决定。如果获得批准,SFDA 将颁发 MDMA证书。
注意事项和常见问题
1. 沙特UDI:
沙特对在其市场内流通的医疗器械有唯一标识的要求(具体见MDS – REQ 7文件),且在SFDA-MD-92020文件中说明了强制实施的最后期限,如下: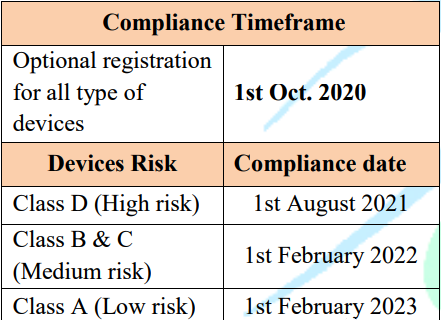
也就是说,明年2月份开始,所有进入沙特市场流通的医疗器械都将带有唯一标识,以便当局管理很追溯。
2. 如何转移许可证到新的授权代表AR?
需要一个新的 AR 许可证。您必须先取消现有的 AR 许可证,然后再申请新的许可证。如果您的 MDMA 申请正在处理中,您将无法提交 AR 转移请求。
3. 可以选择多个 AR 吗?
可以,您可以为所有产品类别使用一个 AR,也可以为同一类别的不同产品指定不同AR。
4. 我们需要 AR 许可证吗?
如果您是第一次进入沙特市场,您必须通过 SFDA 医疗器械企业许可系统 (MDEL) 获得 AR 许可。
5. 谁“拥有” MDMA 许可——AR 还是制造商?
MDMA 以制造商的名义发行;制造商拥有注册。
