全球各地医疗器械 UDI 合规时间表
合规秘笈 2022-08-03唯一设备标识符(UDI)现在是在美国销售的医疗设备的一项要求,UDI 系统旨在为医疗保健用品提供者、制造商、授权的卫生当局、医院和机构以及个人消费者提供:识别医疗设施中使用的任何假冒产品。... 阅读全文
标准解读 UDI 唯一器械标识
澳大利亚 UDI(唯一医疗器械标识码)情况介绍
多国法规 2022-07-27向患者提供更多关于其正使用的医疗器械信息。随着近期澳大利亚推出了其UDI数据库(AusUDID)测试版本,是否澳大利亚也需要像美国和欧盟一样上传UDI信息呢?03澳大利亚UDI适用范围澳大利亚UDI将适用于除定制医疗器械和某些医疗器械外的所有投放市场的医疗器械。制造商必须确保其质量管理体系使用适当的验证机制,制造商必须确保在医疗器械、标签和包装上输入的信息的一致性和有效性;... 阅读全文
UDI 唯一器械标识 其他国家 澳大利亚 TGA
FDA 对 I 类和未分类设备的 UDI 要求
美国法规 2022-07-26本指南反映了 FDA 的信念,即继续集中 FDA 的资源解决 UDI 实施问题和高风险设备的数据质量非常重要。... 阅读全文
美国 FDA 注册 美国代理人 UDI 唯一器械标识
唯一设备标识:FDA 关于 I 类和未分类设备以及某些需要直接标记的设备的合规日期的政策
美国法规 2022-07-21FDA独特的设备识别系统旨在通过分销和使用充分识别设备。其要求旨在根据主要基于设备分类的既定合规日期在七年内分阶段实施。为I类和非分类设备(植入式、生命支持或生命维持(I/LS/LS)设备除外)确定的合规日期为:标签(21CFR801.20、21CFR801.50)和全球唯一设备识别数据库(GUDID)数据提交(21CFR830.300);本指南描述了FDA对I类和未分类设备执行这些要求的意图。... 阅读全文
UDI 唯一器械标识 美国法规
中国医疗器械唯一标识(UDI)实施释疑
中国法规 2021-06-25由注册人/备案人将唯一标识的产品标识及关联信息按照相关标准和规范上传至数据库,医疗器械经营企业、医疗机构、政府相关部门及公众可通过数据查询、下载、数据对接等方式共享唯一标识数据。在注册/备案管理系统中提交其产品标识。在产品上市销售前应当完成医疗器械唯一标识产品标识和相关数据的上传。《规则》实施之日前已生产、销售的医疗器械可不具备医疗器械唯一标识。... 阅读全文
UDI 唯一器械标识 中国法规 中国 NMPA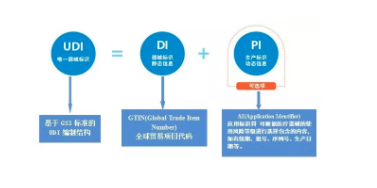
MDR/IVDR新法规中的各类代码你都清楚了吗?
欧盟法规 2021-06-25每个制造商、欧盟代表、进口商都需要在Eudamed数据库里有这个唯一性识别码,SRN是是明确识别欧盟经济运营商的一种代码。SRN的具体申请手续以及欧盟境外企业申请SRN时的信息核对方法,制造商在递交CE认证申请时需要提供认证产品的Basic UDI-DI。... 阅读全文
CE-MDR 欧盟 CE 认证 CE-IVDR UDI 唯一器械标识 SRN 单一注册号
什么是 UDI?医疗器械标识欧盟Basic UDI-DI法规解析
欧盟法规 2021-06-25越来越多的生产商已经开始在欧盟新法规框架下进行CE认证。生产商应当在欧洲医疗器械数据库(EUDAMED)中对其医疗器械产品进行注册并登记相关的唯一医疗器械标识(UDI)。用于连接具有相同预期用途、风险等级和基本设计和制造特征的器械,产品相关文档中也需要列明Basic UDI-DI。Basic UDI-DI独立于器械的UDI-DI, 产品是否有相同的生产商单一注册编号(SRN):... 阅读全文
欧盟 CE 认证 UDI 唯一器械标识 欧盟法规
国内医疗器械唯一标识UDI来了,2021年起正式实施!
中国法规 2020-12-30国家药品监督管理局医疗器械技术审评中心网站挂出通告(如下),关于在eRPS系统提交医疗器械唯一标识有关事项的通告,根据2020年9月30日发布的《国家药监局 国家卫生健康委 国家医保局关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》(2020年 第106号),按照《国家药监局关于做好第一批实施医疗器械唯一标识工作有关事项的通告》(2019年第72号)有关要求。... 阅读全文
UDI 唯一器械标识 中国法规 中国 NMPA