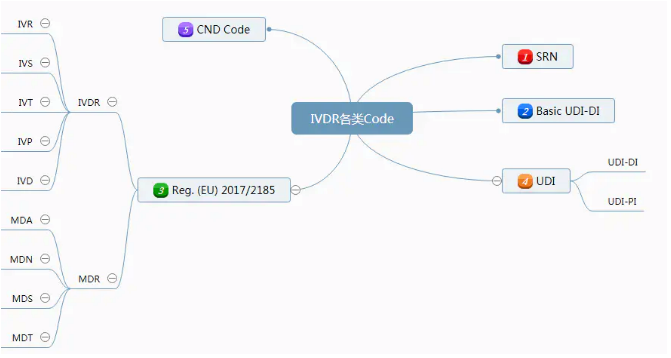
医疗器械CE认证中,MDR Reg 2017/745将取代之前的两大指令Directive 90/386/EEC和Directive 93/42/EEC,IVDR Reg 2017/746将取代之前的指令Directive 98/79/EC。医疗器械的CE认证市场正在经历一个洗牌的过程,那么,新法规中的各类code你都了解清楚了吗?
Single Registration Number (SRN)
根据IVDR Article 28/MDR Article 31,每个制造商、欧盟代表、进口商都需要在Eudamed数据库里有这个唯一性识别码,SRN是是明确识别欧盟经济运营商的一种代码。主管当局负责对申请的信息进行核对后签发SRN,制造商在向公告机构申请CE时,需要提供它。
当然啦,SRN的具体申请手续以及欧盟境外企业申请SRN时的信息核对方法,目前还在制定当中。
Basic UDI-DI
Unique Device Identifucation (UDI)是医疗器械的“电子身份证”,和特定制造商生产的特定器械关联的唯一性的一套编号。
Basic UDI-DI 用于CE认证中。制造商在递交CE认证申请时需要提供认证产品的Basic UDI-DI,这个UDI信息还需体现在制造商签发的EU Declaration of Conformity 、公告机构颁发的CE证书、Summary of safety and performance、自由销售证明。一个Basic UDI-DI可以覆盖一个或多个UDI-DI产品,目的在于识别和连接具有相同预期用途、风险等级以及基本设计和制造特征的器械。
UDI-DI&UDI-PI
IVDR和MDR中还涉及另一类UDI,UDI-DI和UDI-PI。它是在产品标签上显示的一组条形码或二维码或RFID芯片。
UDI-DI包括制造商和产品名称信息,同一个产品的UDI-DI是固定不变。
UDI-PI包括产品批号、效期、生产日期等信息,每批次产品都不同。
欧盟委员会在发布的Commission Implementing Decision (EU)2019/939中,正式授权了这四家机构为发码机构:GS1 AISBL 、HIBCC、 ICCBBA、 IFA GmbH

法规中也规定了UDI实施的最后期限:
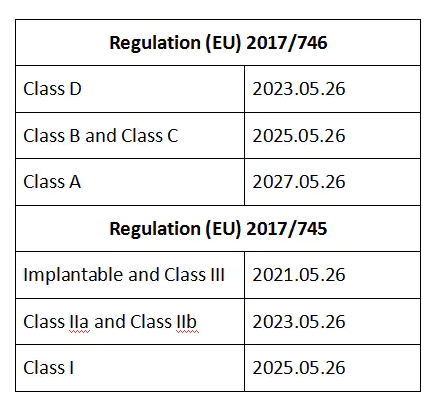
虽然有些实施日期还没到,但相关的流程性文件需要在申请CE认证前起草好。
Classificazione Nazionale dei Dispositivi medici (CND)
MDCG在今年1月份出台了关于CND的指南文件,欧盟将采用意大利政府制定的CND与Eudamed直接关联。CND是一个意大利语的缩写,全称叫国家医疗器械分类。
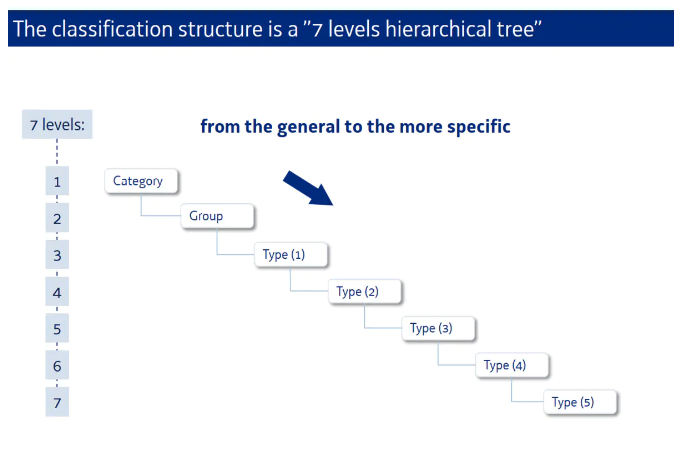
CND由3部分组成:产品种类(1位大写字母)+组别(2位数字)+品种(最多五组2位数字)。在CND体系下,一个医疗器械最多包含七个水平的信息,由上至下,产品特征越来越具体:
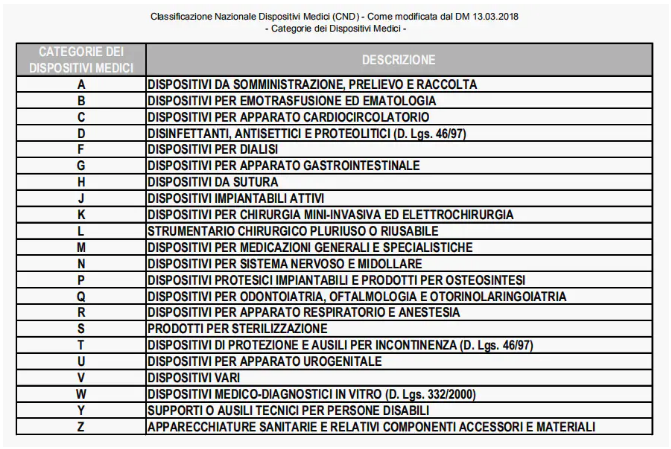
CND的第一层级产品种类分为22个大类,体外诊断CND都为W开头:
Reg. (EU) 2017/2185
在向公告机构申请CE时,企业需要根据Commission Implementing Regulation (EU) 2017/2185填写各类代码:
附录1:The list of codes under Regulation (EU) 2017/745
MDA(有源器械类别)、MDN(无源器械类别)、MDS(特定类别)、MDT(生产工艺)
附录2:The list of codes under Regulation (EU) 2017/746
IVR(试剂盒类型)、IVS(特定类别)、IVT(生产工艺)、IVP(方法学)、IVD(应用领域)
另外,公告机构对产品CE技术文件的抽样也会基于这些代码。