中国医疗器械唯一标识(UDI)实施释疑
2021-06-25由注册人/备案人将唯一标识的产品标识及关联信息按照相关标准和规范上传至数据库,医疗器械经营企业、医疗机构、政府相关部门及公众可通过数据查询、下载、数据对接等方式共享唯一标识数据。在注册/备案管理系统中提交其产品标识。在产品上市销售前应当完成医疗器械唯一标识产品标识和相关数据的上传。《规则》实施之日前已生产、销售的医疗器械可不具备医疗器械唯一标识。
什么是UDI?
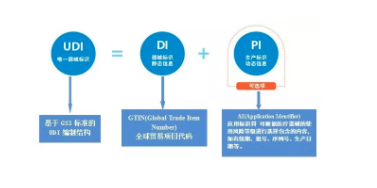
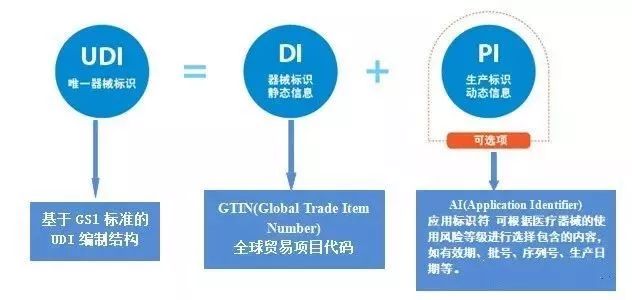
医疗器械唯一标识(Unique Device Identification,简称UDI),是医疗器械产品的电子身份证。
UDI 由DI 和PI 两部分组成
UDI实施释疑
医疗器械唯一标识实施遵循哪些原则?
如何实现唯一标识数据汇聚和共享?
《规则》施行前已上市产品是否需要赋予唯一标识?
《规则》实施之日起,注册人/备案人应当在申请相关医疗器械注册、注册变更或者办理备案时,在注册/备案管理系统中提交其产品标识。相关医疗器械产品应当在生产过程中赋予医疗器械唯一标识,在产品上市销售前应当完成医疗器械唯一标识产品标识和相关数据的上传。
《规则》实施之日前已生产、销售的医疗器械可不具备医疗器械唯一标识。
如何选择医疗器械唯一标识数据载体?
发码机构需要具备什么样的资质,其职责和义务有哪些?
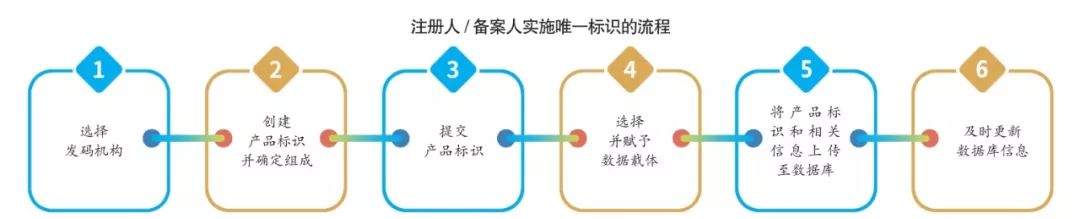
备案人实施唯一标识的流程是什么?
第一步:注册人/备案人按照《规则》和相关标准,结合企业实际情况选择发码机构。
第二步:注册人/备案人按照发码机构的标准创建产品标识,并确定该产品生产标识的组成。
第三步:《规则》实施之日起,申请医疗器械注册、注册变更或者办理备案的,注册人/备案人应当在注册/备案管理系统中提交产品标识。
第四步:注册人/备案人根据发码机构标准选择适当的数据载体,对医疗器械最小销售单元和更高级别的包装或医疗器械产品赋予医疗器械唯一标识数据载体。
第五步:注册人/备案人在产品上市销售前将产品标识和相关信息上传至医疗器械唯一标识数据库。
第六步:产品标识及数据相关信息变化时,注册人/备案人及时更新医疗器械唯一标识数据库。
