【关注】产品出口美国的先决条件“FDA注册”及“美国代理人”
美国法规 2020-10-12FDA要求所有的美国国外的企业必须告知FDA其美国代理人(US AGENT)的联系方式,美国代理人的信息通过FDA FURLS系统(FDA Unified Registration and Listing System)提交至FDA,510k注册也需要提交美国代理人的信息。美国代理人要求必须是美国居民或在美国拥有一个办公处所且美国代理人必须能在工作时间接听FDA的电话。... 阅读全文
美国 FDA 注册 FDA 510K 美国代理人
如何获得FDA批准
美国法规 2020-07-09如何获得FDA(美国食品药品监督管理局)批准取决于在美国销售产品的类型。FDA并不要求所有产品获得批准。了解哪些产品需要并获得FDA的批准。FDA并不要求食品企业获得任何形式的认证或批准才允许食品上市销售,新型的食品添加剂确实需要获得FDA的批准,一种新的药品是否需要获得FDA的批准取决于该产品是否符合非处方药(OTC)药典专著,药品企业可以直接销售符合药典专著的药品而不需要向FDA获得审批。... 阅读全文
美国 FDA 注册
FDA认证意味着什么?如何认证?
美国法规 2020-07-09只有拥有了FDA认证的食品、化妆品、药品等才可以进入美国市场销售。通过FDA认证的食品、化妆品和医疗器械对人体是确保安全而有效的。哪些产品需要进行FDA认证呢?FDA作为美国最早的消费者保护机构,负责美国所有有关食品、药品、化妆品及辐射性仪器的管理认证。凡是美国本土生产或美国进口销售的食品、药品、化妆品等都必须经过FDA认证才可以进入美国市场销售。那么如何做FDA认证呢?... 阅读全文
美国 FDA 注册
新冠试剂FDA注册
美国法规 2020-03-17美国FDA近期给出了新冠试剂盒的紧急使用授权:FDA 2019新型冠状病毒(2019 nCoV)体外诊断设备紧急使用授权(EUA)。o [FDA希望看到的其他信息-针对这类医疗器械产品];请通过电子邮件(包括word中的EUA审查模板)向FDA提交你的预EUA包至Kim.Sapsford@FDA.hhs.gov:您的预EUA提交包也应发送到CDRH文件控制中心(DCC)。... 阅读全文
美国 FDA 注册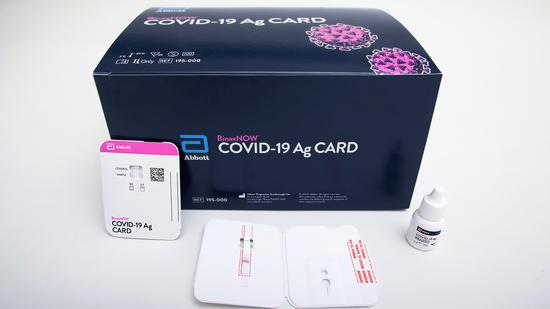
SARS-CoV-2诊断测试的常见问题解答
合规秘笈 2020-03-17我将根据《临床实验室和食品和药物管理局工作人员立即生效指南》中概述的新政策提供我自己的测试:在获得针对冠状病毒病的紧急使用授权之前已通过CLIA进行高复杂性测试的实验室的诊断测试政策-2019年公共卫生紧急事件期间。已通过CLIA认证进行了高度复杂性测试的实验室诊断测试政策,FDA认为CDC的EUA授权测试可以在以下旨在检测RNA病毒的仪器上进行。... 阅读全文
美国 FDA 注册 欧盟 CE 认证
FDA检查的含义
美国法规 2019-08-222012年开始实施的FDA安全与创新法案废除了过去要求FDA每两年检查一次生产场地的规定,要求基于场地的合规历史、召回情况、所生产医疗器械的风险、场地的检查历史、是否由外国监管机构检查过等风险因素来考虑检查频率“检查员无权告知企业是否通过检查。但在检查期间会向企业明确表示观察项的重要性和不采取应对措施的后果。... 阅读全文
美国 FDA 注册 警告信
无线医疗系统的认证要求
合规秘笈 2019-08-22产品的设计上是如何保证无线传输的准确。怎样保护医疗器械不和别的无线装置进行错误的连接和数据交换,6、数据传输的安全性可靠性,如何和指定的接受装置进行识别和数据传递,数据传递的实时性如何保证,系统如何识别和自动记录安全漏洞。版本自动更新功能等Firewall的设置,使用encryption来保证数据的安全传输,确保紧急功能的畅通(即使数据不安全的情况下),列出系统所有可能的安全隐患:... 阅读全文
美国 FDA 注册 FDA 医疗器械
什么是 FDA 510(k) ?
美国法规 2019-08-22• 对于产品认可过中进行的调查、分析、研究以及相关规定的执行情况。不同等级的产品进行上市前认可时程序不同。二类以上的产品按照认可程序进行:1. 制造商、流通商、包装商等符合CFR 807.2中规定的公司进行公司注册(Registration),确认具有潜在的重大危险时马上禁止该医疗器械的流通:依法保证医疗器械的安全性和有效性时:7. 1和2的设备及产品注册情况要每年向FDA报告CLASS II。... 阅读全文
FDA 510K 美国 FDA 注册
FDA医疗器械现场审核特点
美国法规 2019-08-20只有特定情况下才会实施现场GMP审核。产品在美国市场上市多年后才会第一次接受到FDA的现场审核,FDA审核员查询的记录涉及的周期就会很长。FDA审核则更直击企业软肋。FDA现场审核的特点:FDA审核基本专注于过往美国订单的相关记录,在审核前的通知里都会要有企业列明过往(获得FDA批准后)所有销往美国的订单,FDA审核员可能会查看非常多的订单记录。... 阅读全文
FDA 医疗器械 美国 FDA 注册
