关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(2021年第121号令)
中国法规 2021-10-09根据《医疗器械监督管理条例》(国务院令第739号)和《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号),国家药监局组织制定了医疗器械注册申报资料要求和批准证明文件格式(见附件),原国家食品药品监督管理总局发布的《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(原国家食品药品监督管理总局公告2014年第43号)同时废止。... 阅读全文

什么是产品自由销售证书?新冠病毒试剂盒FSC证书怎么办理?
欧盟法规 2021-06-29自由销售证书的主要作用是用于出口货物清关以及产品的的登记和注册,也是用于证明所出口的货物是符合国家有关部门的生产标准和生产许可的重要凭证。越来越多的国家和地区(详见下文)都要求货物出口商在进口其国家时需提供一份由出口国相关机构认证的自由销售证明书才能在其国家顺利清关。自由销售证书是贸易出口并由国外客人向货物出口商提出申请用于货物清关必需的清关文书,也是用于为注册产品进口所用的重要文件。... 阅读全文
FSC 自由销售证
新冠试剂盒的欧盟注册怎么做?
欧盟法规 2021-06-29我司可供英国、荷兰和德国欧盟授权代表、欧盟注册、MHRA注册、欧盟自由销售证书FSC、欧盟CE认证、CE技术文件编写、CE第四版临床评估报告编写、MDR转版咨询服务 TEL:欧盟授权代表(European Authorized Representative )是指由位于欧洲经济区EEA(包括EU与EFTA)境外的制造商明确指定的一个自然人或法人。... 阅读全文
欧盟 CE 认证
中国医疗器械唯一标识(UDI)实施释疑
中国法规 2021-06-25由注册人/备案人将唯一标识的产品标识及关联信息按照相关标准和规范上传至数据库,医疗器械经营企业、医疗机构、政府相关部门及公众可通过数据查询、下载、数据对接等方式共享唯一标识数据。在注册/备案管理系统中提交其产品标识。在产品上市销售前应当完成医疗器械唯一标识产品标识和相关数据的上传。《规则》实施之日前已生产、销售的医疗器械可不具备医疗器械唯一标识。... 阅读全文
UDI 唯一器械标识 中国法规 中国 NMPA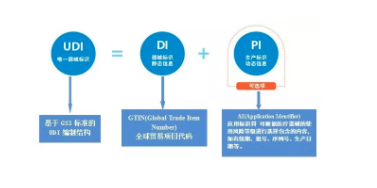
欧盟医疗器械单一注册号SRN码你申请了吗?
欧盟法规 2021-06-25都要求使用这个SRN注册模块。在向公告机构申请符合性认证、访问 Eudamed、现场安全通告、安全和临床性能总结、欧盟符合性声明和向 UDI 数据库登记UDI时都需要使用在Eudamed注册后获得的SRN(单一注册号)。在Eudamed中注册的信息需要在首次注册1年内进行一次准确性确认,注册功能模块会生成MDR第32条第2款提及的独一无二的单一注册号(SRN)。... 阅读全文
欧盟 CE 认证 SRN 单一注册号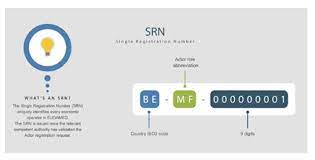
MDR/IVDR新法规中的各类代码你都清楚了吗?
欧盟法规 2021-06-25每个制造商、欧盟代表、进口商都需要在Eudamed数据库里有这个唯一性识别码,SRN是是明确识别欧盟经济运营商的一种代码。SRN的具体申请手续以及欧盟境外企业申请SRN时的信息核对方法,制造商在递交CE认证申请时需要提供认证产品的Basic UDI-DI。... 阅读全文
CE-MDR 欧盟 CE 认证 CE-IVDR UDI 唯一器械标识 SRN 单一注册号
什么是 UDI?医疗器械标识欧盟Basic UDI-DI法规解析
欧盟法规 2021-06-25越来越多的生产商已经开始在欧盟新法规框架下进行CE认证。生产商应当在欧洲医疗器械数据库(EUDAMED)中对其医疗器械产品进行注册并登记相关的唯一医疗器械标识(UDI)。用于连接具有相同预期用途、风险等级和基本设计和制造特征的器械,产品相关文档中也需要列明Basic UDI-DI。Basic UDI-DI独立于器械的UDI-DI, 产品是否有相同的生产商单一注册编号(SRN):... 阅读全文
欧盟 CE 认证 UDI 唯一器械标识 欧盟法规
什么是ISO 13485质量管理体系认证?
体系标准 2021-06-25编写ISO 13485的目的是支持医疗器械制造商设计质量管理体系,保持体系合规ISO 13485标准是满足QMS综合要求的有效解决方案。为制造商满足医疗器械指令、法规和对产品安全和质量的承诺提供了实践基础。获得此认证是组织对客户和监管机构的质量承诺。概述如何评估和改进流程提高效率、削减成本并监控绩效证明您生产安全的医疗器械符合法规要求和客户期望EN ISO 13485:... 阅读全文
ISO 体系 ISO 13485
企业怎样申请MDSAP认证?
体系标准 2021-06-25医疗器械单一审核程序”MDSAP认证项目是美国(FDA)、澳大利亚(TGA)、巴西(ANVISA)、加拿大(HC)、日本(MHLW)五国的监管机构认可并加入的一套新的审核程序,满足并统一上述国家的审核要求,以上五国监管机构认可MDSAP的审核结果。生产企业可以减少对应不同监管机构的审核次数,使审核过程国际标准化,MDSAP由医疗器械生产企业联系第三方公告机构(如:... 阅读全文
MDSAP
什么是MDSAP认证?MDSAP医疗器械单一审核程序
体系标准 2021-06-25医疗器械单一审核程序MDSAP(Medical Device Single Audit Program (MDSAP)是由国际医疗器械监管机构论坛(IMDRF)的成员共同发起的项目。对医疗器械生产商进行一次审核即可满足参与国不同的QMS/GMP要求。该项目已经获得五家监管机构美国食药品监督管理局 FDA。... 阅读全文
MDSAP
