巴西医疗器械认证简介
2022-07-081主管机构和核心法规巴西是拉丁美洲最大的医疗器械市场,医疗器械是由巴西国家卫生监督局(ANVISA)负责监管。巴西现行医疗器械法规RDCANVISA16/2013和欧洲的MDD93/42/EEC规定较为相似。2产品分类RDCNO.185附录II阐述了巴西对医疗器械的分类,体外诊断设备根据产品预期用途风险。


1 主管机构和核心法规
巴西是拉丁美洲最大的医疗器械市场,并且拥有一个完善但是比较复杂的监管体系。在巴西,医疗器械是由巴西国家卫生监督局(ANVISA)负责监管。巴西现行医疗器械法规RDC ANVISA 16/2013和欧洲的MDD 93/42/EEC规定较为相似。
2 产品分类
RDC NO. 185附录II阐述了巴西对医疗器械的分类,类似于欧盟的分类规则。根据对人体造成可能风险的高低,由低到高,医疗器械被分为四类,即I类、IIa类、IIb类和III类。体外诊断设备根据产品预期用途风险,也分为四类,即I类、II类、III类和IV类。
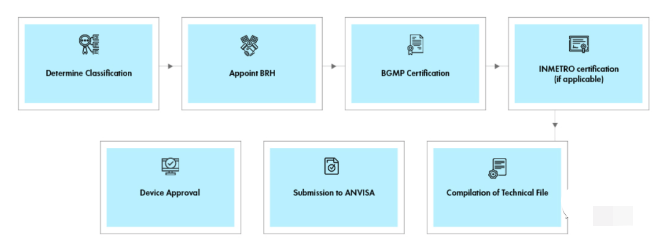
3 认证模式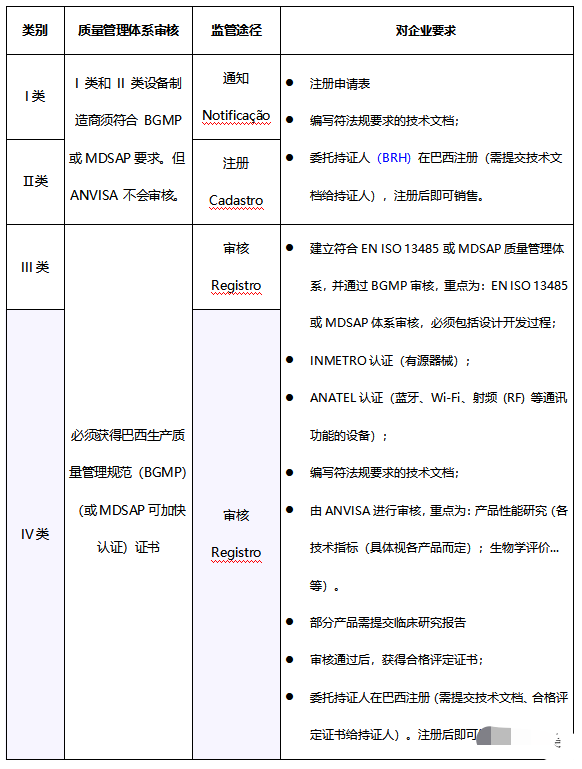
注意事项
1 巴西注册持有人(BRH)
打算在巴西销售其医疗器械的外国制造商必须指定一名巴西注册持有人 (BRH),负责向 ANVISA 提交必要文件以进行注册程序的当地代表。BRH 在适用的情况下保持对制造商设备注册和 BGMP 认证的控制。BRH 还参与与分销商协调每批货物的进口授权。
2 INMETRO认证
根据RDC 27/2011法规,电子电器类医疗产品必须先取得INMETRO证书。证书有效期为5年。
3 关于ANATEL
Anatel是巴西负责监管该国电信部门的机构。根据第 242 号决议,具有蓝牙、Wi-Fi、射频 (RF) 等特定功能的设备需要 ANATEL 认证,即所有发往巴西市场电信链的产品都必须有 Anatel 认证。
4 审核流程