欧盟发布MDCG 2022-16,关于授权代表的最新指南!
2022-11-03如果临床研究和性能研究的申办者在欧盟境内没有进行商业注册/登记,则该申办者需要在欧盟境内确立自然人或法人为其法定代表人。... 查看详情

欧盟MDR的NB机构增至34家!20天内连增2家
2022-10-15又新增了一家在MDR法规下的NB机构:已经获得授权的MDR公告机构一共达到了34家。34家MDR法规NB机构清单ENTECERTIFICAZIONEMACCHINESRL这家NB机构来自意大利,该NB机构就可以在欧盟内的医疗器械领域广泛地作为公告机构开展工作。意大利境内的MDR公告机构已经达到了9家,成为欧盟拥有MDR公告机构最多的国家。... 查看详情

第32家MDR NB公告机构来了
2022-08-052022年8月3日,欧盟又带来了新消息:在欧盟官方的NANDO database中,新增一家在MDR法规下的NB机构: BUREAU VERITAS ITALIA S.P.A. 。截至目前,已经获得授权的MDR公告机构一共有32家。... 查看详情

202207 | 欧盟新冠抗原检测通用清单 A 和 B 最新要求
2022-08-04相互认可的实验室抗原检测清单2022年6月10日更新内容中:将抗原快速检测和基于实验室的抗原检测纳入EUCommonlist的清单中。根据评价要求不同将抗原快速检测分为:2022年7月22日取消相互认可的COVID-19实验室抗原检测清单,根据评价要求不同将抗原快速检测分为A和B两类:A类包含的抗原快速测试,B类包含的抗原快速测试,A类中A.1包含的COVID-19快速抗原检测产品。... 查看详情
【重要通知】第十四届中国医疗器械国际化法规论坛通知
2022-08-02越来越多的中国医疗器械产品走向国际市场,医疗器械产业爆发式的发展促使各国(地区)在医疗器械监管方面出台了大量新政策。为使中国的医疗器械企业深入了解中国、欧盟、美国、日本、加拿大等国家和地区新法规、新标准的要求,提高中国医疗器械的技术水平、产品质量和市场竞争能力。... 查看详情

202207 | 欧盟更新 MDR 和 IVDR 实施滚动计划
2022-07-28IVDR实施滚动计划”该滚动计划包含委员会已通过或打算在未来通过的已确定的基本实施法案和其他相关举措的清单。实施行为和其他行动/倡议。该文件每季度进行一次审查,以便为国家监管者和利益相关者提供最新信息。2022第三季度的滚动计划中有待完成的项目总结如下:实施计划根据此滚动计划,结合MDCG指南的编制计划,欧盟委员会在逐步完善MDR&IVDR实施。制造商需要根据当局释放的这些法规计划。... 查看详情


202207快讯 | 欧盟宣布推迟EUDAMED数据库功能开发
2022-07-11欧盟委员会更新了欧洲医疗器械数据库EUDAMEDTimeline,根据最新的时间表,EUDAMED数据库将在2023年第四季度完成6个模块的开发并于2024年上半年进行审核。如果该审核顺利通过MDCG小组的评估,新版EUDAMED数据库将立即通过欧盟官方公报(OJEU)正式发布。2最新过渡期值得制造商注意的是,OJEU发布公报之后将产生两个过渡期。... 查看详情

印度10月后将强制注册,可能会影响很大一批没有进口资质的企业出口
2022-07-11所有剩余的未通知的C类和D类设备都需要获得进口许可证。4-审核流程-所有医疗器械都必须注册或拥有进口许可证。需要进口许可证的产品类型的完整列表可以在本页底部找到。设备类别需要通过提交每个产品的设备主文件(DMF)和每个制造场所的工厂主文件(PMF)来获得进口许可证。医疗器械将根据与主要制造地点相关的进口许可证进行注册。其余未通知的C类和D类设备需要在2023年10月1日之前获得进口许可证。... 查看详情

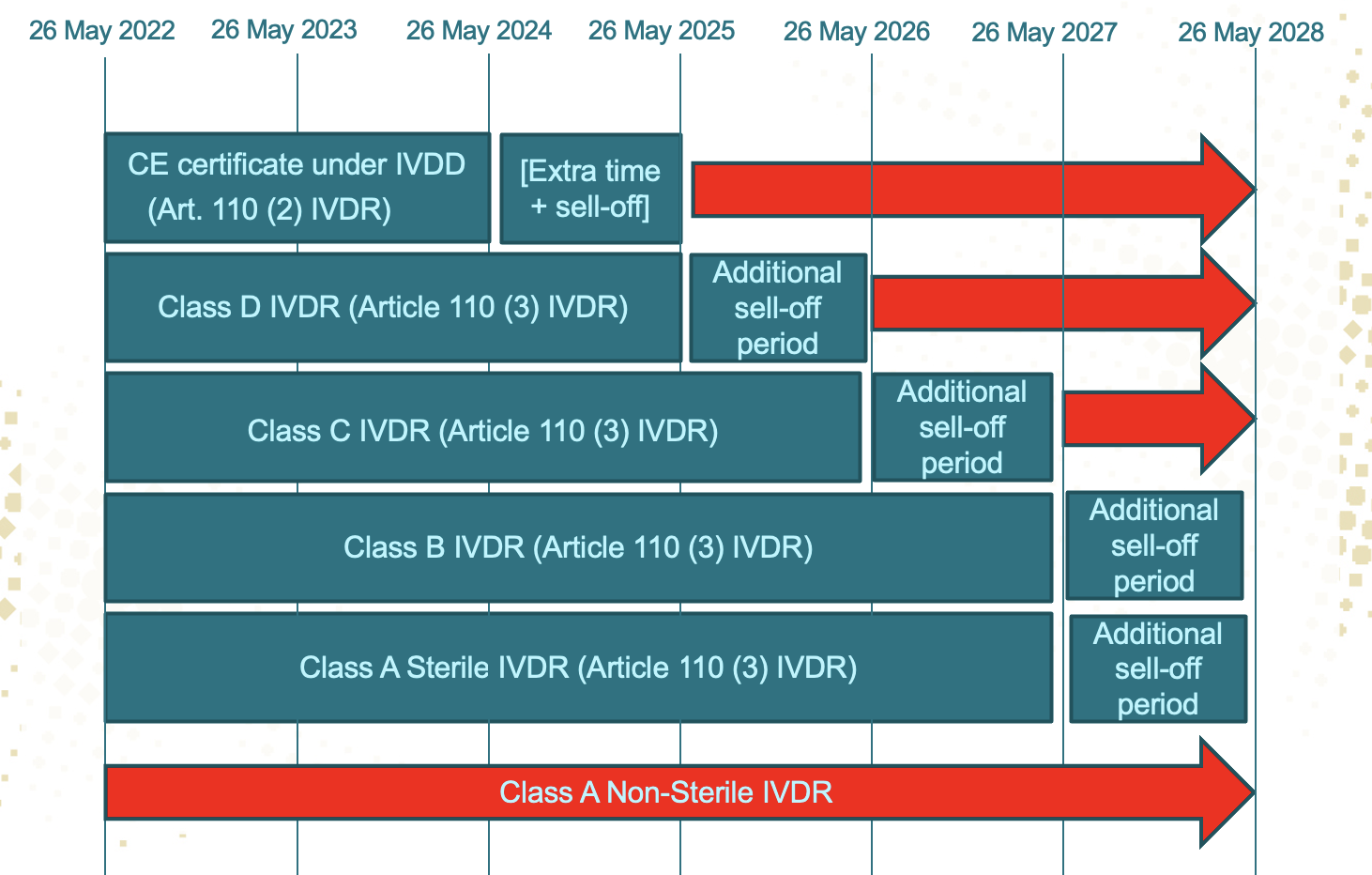
IVDR确定延期!!
2022-02-081、过渡期总体由 推迟到 2、在2022.5.26之前完成了NB发证的IVDD下ListA,之前完成了IVDD符合性声明(欧盟注册)的,之后完成IVDD符合性声明(欧盟注册)的,2022.5.26 PMS、警戒系统、经济运营商注册这些要求,企业需及时更新QMS,同时依据IVDR要求实施企业注册、产品注册等;6、根据释疑 Q&... 查看详情