202208 | FDA 提供机构应对猴痘疫情的最新情况
2022-08-04
最新情况
2022年7月29日,FDA正在提供其在美国对猴痘的多管齐下应对的最新情况,包括其在诊断,疫苗和治疗领域的努力。该机构还建立了一个专门的网站,提供有关FDA正在进行的与猴痘有关的监管活动的重要信息以及常见问题。FDA将随着事态发展提供更新,并将继续与联邦公共卫生合作伙伴和行业合作,以确保及时获得所有可用的医疗对策。
1 什么是猴痘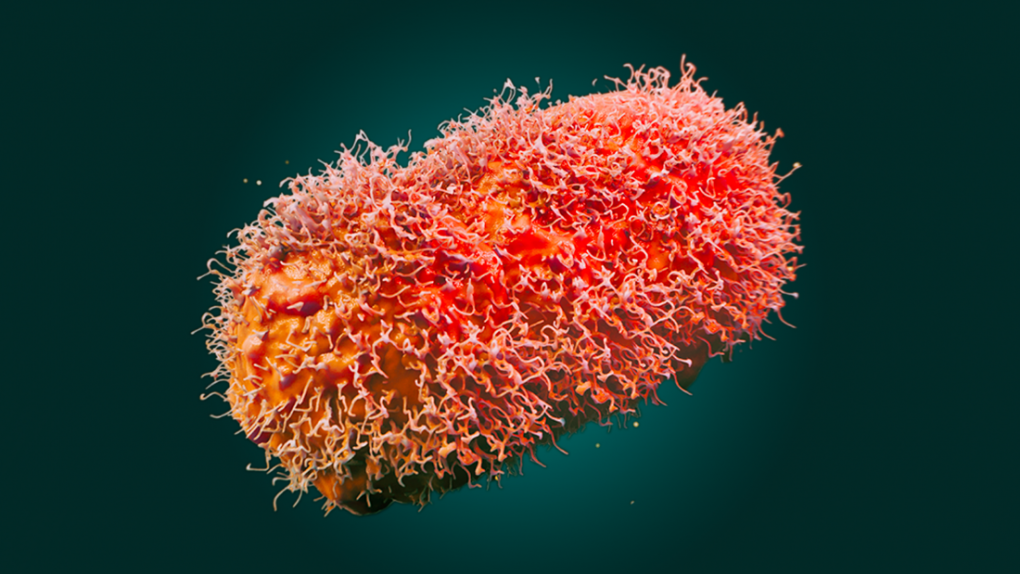
猴痘病毒与天花病毒属于同一家族病毒,天花病毒是引起天花(一种已在全球根除的病毒)的病毒。猴痘和天花都属于“正痘病毒”类别。猴痘通常不会致命,通常无需治疗即可自行消退。美国目前的疫情通常表现为身体、面部或生殖器部位的皮疹。虽然死亡风险非常低,但据报道有并发症,包括剧烈疼痛,有时需要住院治疗。
2 诊断
自从在美国发现第一例猴痘病例以来,FDA一直在与商业实验室和制造商合作,使有需要的消费者更容易获得猴痘检测。美国疾病控制和预防中心(CDC)有一项FDA批准的非天花正痘病毒检测,可以通过猴痘病变(皮疹或生长)的拭子检测猴痘。目前,这是唯一一项获得FDA批准的测试。FDA不知道临床数据支持使用其他样本类型(如血液或唾液)进行猴痘病毒检测。2022年7月,FDA发布了一份安全通讯,建议人们在检测猴痘病毒时使用直接从病灶采集的拭子样本。
FDA批准的猴痘测试由CDC和包括CDC公共卫生实验室响应网络在内的许多实验室提供。此外,联邦公共卫生当局还与工业界合作,通过五个大型商业实验室提供该测试。该机构正在与CDC密切合作,以增加其FDA批准的测试的产量,FDA已批准使用额外的试剂和仪器来提高CDC测试的通量。
FDA将继续与诊断界合作,增加获得准确检测的机会,以支持应对措施。
3 疫苗
2019年,FDA批准了JYNNEOS疫苗,用于预防18岁及以上被确定为感染高风险的成年人的天花和猴痘。JYNNEOS是美国唯一被批准用于预防猴痘的疫苗。尽管临床试验和数据有限,因为迄今为止病例数量很少,但对疫苗施用的免疫反应与有效预防该疾病一致。
在刚刚出现的公共卫生危机之后,FDA意识到,在批准在生产疫苗的一家工厂的额外生产能力之后,今年秋天有近80万剂这种疫苗等待发布。考虑到这一点,该机构与HHS合作伙伴合作,并加快了提交公司制造变更所需的申请,以便将这些剂量提供给有需要的人。在将工厂检查的时间表从秋季缩短到本月早些时候之后,FDA已经完成了对验证产品质量所需信息的评估,并确定疫苗符合其质量标准。
7月26日,该机构批准了JYNNEOS疫苗生物制剂许可证的补充,以允许该设施具有额外的生产能力。鉴于新兴的公共卫生需求,FDA此前曾为将制造剂量运往美国提供便利,以便在制造变更获得批准后即可分发。随着补充剂的批准, 这些制造的剂量现在可以进一步分配和管理.该工厂生产的额外剂量可以帮助解决对这种疫苗的需求。
4 疗法
没有FDA批准或授权的药物用于治疗猴痘病;然而,TPOXX(tecovirimat)是一种抗病毒药物,正在通过CDC根据FDA当局提供的称为“扩大获取”或“同情使用”。FDA继续与CDC合作,简化其猴痘扩大获取计划,以促进获取。
目前没有人类数据证明TPOXX治疗猴痘的功效,或者安全性和药代动力学特征(这有助于我们了解人体对药物的作用)。虽然有扩大的可及性计划,但进行随机对照试验以评估TPOXX在猴痘感染人群中的安全性和有效性至关重要。
FDA在其猴痘网页上有更多关于TPOXX根据“动物规则”法规批准天花的信息。
