欧盟MDR的NB机构增至34家!20天内连增2家
2022-10-15又新增了一家在MDR法规下的NB机构:已经获得授权的MDR公告机构一共达到了34家。34家MDR法规NB机构清单ENTECERTIFICAZIONEMACCHINESRL这家NB机构来自意大利,该NB机构就可以在欧盟内的医疗器械领域广泛地作为公告机构开展工作。意大利境内的MDR公告机构已经达到了9家,成为欧盟拥有MDR公告机构最多的国家。

北京时间2022年10月14日,欧盟官方的NANDO database中,又新增了一家在MDR法规下的NB机构:ENTE CERTIFICAZIONE MACCHINE SRL。截至目前,已经获得授权的MDR公告机构一共达到了34家。距离上一次更新(北京时间2022年9月25日)仅过去了20天,如此高频地增加MDR法规下的NB机构,足以看出欧盟增加审批能力的坚定决心。
34家MDR法规NB机构清单
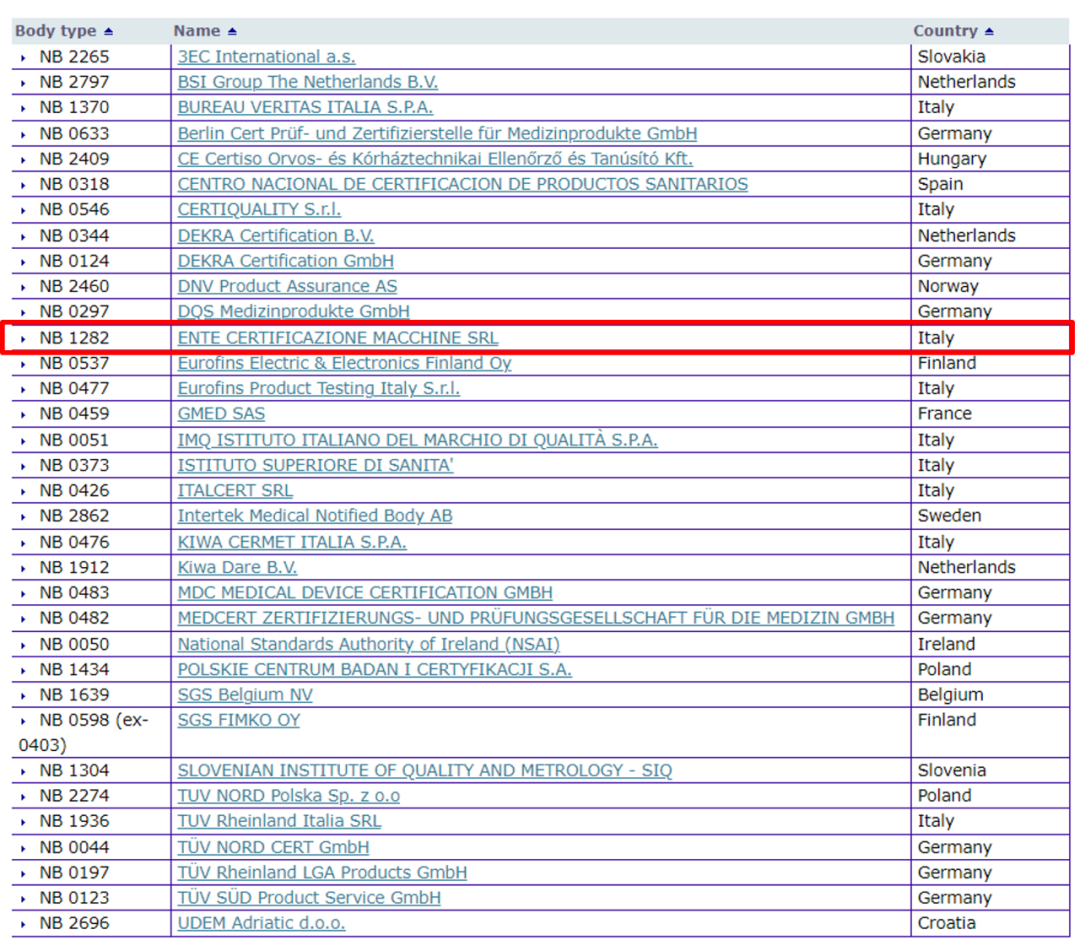
ENTE CERTIFICAZIONE MACCHINE SRL这家NB机构来自意大利,其NB编号为1282。被授权之后,该NB机构就可以在欧盟内的医疗器械领域广泛地作为公告机构开展工作。截至目前,意大利境内的MDR公告机构已经达到了9家,超过德国(8家),成为欧盟拥有MDR公告机构最多的国家。
机构资质详情

