202207快讯 | 欧盟宣布推迟EUDAMED数据库功能开发
2022-07-11欧盟委员会更新了欧洲医疗器械数据库EUDAMEDTimeline,根据最新的时间表,EUDAMED数据库将在2023年第四季度完成6个模块的开发并于2024年上半年进行审核。如果该审核顺利通过MDCG小组的评估,新版EUDAMED数据库将立即通过欧盟官方公报(OJEU)正式发布。2最新过渡期值得制造商注意的是,OJEU发布公报之后将产生两个过渡期。

1 最新消息
近日,欧盟委员会更新了欧洲医疗器械数据库EUDAMED Time line,具体时间表如下: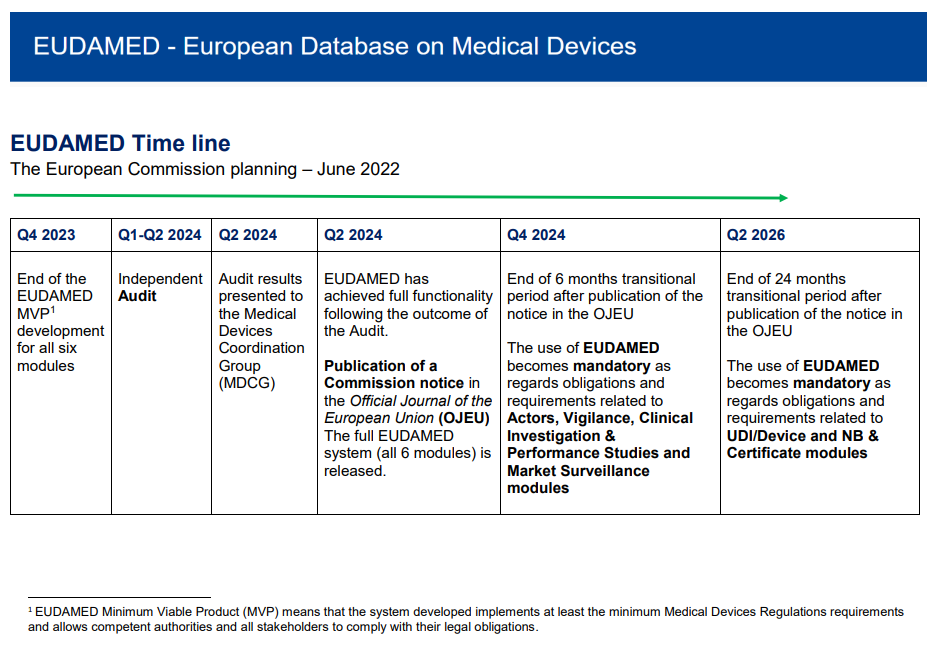
根据最新的时间表,EUDAMED数据库将在2023年第四季度完成6个模块的开发并于2024年上半年进行审核。如果该审核顺利通过MDCG小组的评估,新版EUDAMED数据库将立即通过欧盟官方公报(OJEU)正式发布。
2 最新过渡期
值得制造商注意的是,OJEU发布公报之后将产生两个过渡期,具体内容如下:
Q4 2024: 在OJEU公布后的6个月过渡期结束之后,制造商有义务将Actors, Vigilance, Clinical Investigation & Performance Studies and Market Surveillance modules上传至EUDAMED系统
Q2 2026: 在OJEU公布后的24个月过渡期结束之后,制造商有义务将UDI/Device and NB & Certificate modules上传至EUDAMED系统
